题目内容
某校学生对买来的工业固体烧碱的杂质成分进行研究(已知各组分都是钠元素的化合物)
(1)假设:该固体烧碱中可能含有碳酸钠、氯化钠.
(2)查阅资料:
①在化工生产中原料往往不能全部转化成产品
②在工业上用食盐和水配成饱和食盐水通过电解(通电)制得烧碱溶液,同时还得到氢气和氯气,再将溶液浓缩得到固体烧碱
(3)实验:请你帮助该同学完成下列实验报告
(4)结论:根据实验报告得出:原假设能成立.
(5)试写出工业上用电解饱和食盐水制烧碱的化学方程式
(1)假设:该固体烧碱中可能含有碳酸钠、氯化钠.
(2)查阅资料:
①在化工生产中原料往往不能全部转化成产品
②在工业上用食盐和水配成饱和食盐水通过电解(通电)制得烧碱溶液,同时还得到氢气和氯气,再将溶液浓缩得到固体烧碱
(3)实验:请你帮助该同学完成下列实验报告
| 实验步骤 | 实验现象 | 结论或化学方程式 |
| 1.取样,加足量的水, | 固体完全溶解 | |
| 2.用试管取上述试液,加入过量稀硝酸,塞上带导管的单孔塞;将导管的另一端插入 澄清石灰水 澄清石灰水 中. |
有 气泡 气泡 生成,有 沉淀 沉淀 . |
证明原固体烧碱中含有碳酸钠 |
| 3.向试管中再加入 硝酸银溶液 硝酸银溶液 . |
有 白色沉淀 白色沉淀 生成. |
写出该反应的化学方程式为: AgNO3+NaCl═AgCl↓+NaNO3 AgNO3+NaCl═AgCl↓+NaNO3 |
(5)试写出工业上用电解饱和食盐水制烧碱的化学方程式
2NaCl+2H2O
2NaOH+H2↑+Cl2↑.
| ||
2NaCl+2H2O
2NaOH+H2↑+Cl2↑.
.
| ||
分析:(3)根据检验碳酸钠时用酸和澄清石灰水,检验氯化钠用硝酸银分析现象和结论,注意实验中要排除其他离子的干扰;
(5)根据反应物和生成物按照质量守恒定律书写化学方程式;
(5)根据反应物和生成物按照质量守恒定律书写化学方程式;
解答:解:(3)检验烧碱中可能含有碳酸钠的方法是用加入酸溶液,看生成的气体能否使石灰水变浑浊,为了不影响后面检验氯化钠,故选择硝酸检验碳酸钠,根据生成二氧化碳可判断含有碳酸钠,检验氯化钠用硝酸银,硝酸银和氯化钠反应生成白色的氯化银沉淀.
故答案为:
(5)根据题干提供的信息和质量守恒定律,工业上用电解饱和食盐水制烧碱的化学方程式为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑.
故答案为:
| 实验步骤 | 实验现象 | 结论或化学方程式 |
| 1.取样,加足量的水, | 固体完全溶解 | |
| 2.用试管取上述试液,加入过量稀硝酸,塞上带导管的单孔塞;将导管的另一端插入 澄清石灰水中. | 有 气泡生成, 有 沉淀. |
证明原固体烧碱中含有碳酸钠 |
| 3.向试管中再加入 硝酸银溶液. | 有 白色沉淀生成. | 写出该反应的化学方程式为: AgNO3+NaCl═AgCl↓+NaNO3 |
| ||
点评:通过本题的练习,主要考查了氯离子、碳酸根离子的鉴别,要掌握常见离子的检验方法.

练习册系列答案
相关题目
 在化工生产中,原料往往不能全部转化成产品.某校学生对买来的工业固体烧碱的杂质成分进行研究,他们查阅资料得知:在工业上用食盐和水配成饱和食盐水,通过电解(通电)制得烧碱溶液,再将溶液浓缩即可得到固体烧碱,通电过程中还可得到氢气和氯气(Cl2).他们推测该工业固体烧碱中可能含有碳酸钠、氯化钠,并设计了实验来验证假设.
在化工生产中,原料往往不能全部转化成产品.某校学生对买来的工业固体烧碱的杂质成分进行研究,他们查阅资料得知:在工业上用食盐和水配成饱和食盐水,通过电解(通电)制得烧碱溶液,再将溶液浓缩即可得到固体烧碱,通电过程中还可得到氢气和氯气(Cl2).他们推测该工业固体烧碱中可能含有碳酸钠、氯化钠,并设计了实验来验证假设.(1)请你帮助他们完成实验报告:
| 实验步骤 | 实验现象 | 结 论 |
| ①取样,加足量的水 | 固体完全溶解 | -- |
| ②用试管取上述试液,加入过量稀硝酸,塞上带导管的单孔塞;将导管的另一端插入 |
有 有 |
证明原固体烧碱中含有碳酸钠 |
| ③向试管中再加入硝酸银 | 有白色沉淀生成 | 证明原固体烧碱中含有 |
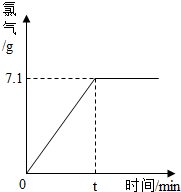
( 3 )现取100g室温下的饱和食盐水(此时质量分数约为26.5%)进行电解,当反应停止后,生成氯气的质量与时间的关系如图所示.请计算:参加反应的氯化钠的质量是多少?反应后所得烧碱溶液的质量分数是多少?(计算结果精确到0.001)
 (2013?丹徒区模拟)某校学生对买来的工业固体烧碱的杂质成分进行研究.
(2013?丹徒区模拟)某校学生对买来的工业固体烧碱的杂质成分进行研究.
