题目内容
在化工生产中,原料往往不能被全部转化成产品。某化工厂用石灰石(杂质不溶于水,也不参加反应)、纯碱、水等原料来制烧碱溶液,再经过滤、蒸发等步骤制取固体烧碱。某化学兴趣小组对化工厂仓库中放置一段时间的固体烧碱样品的成分进行下列分析和探究。
【提出猜想】(1)猜想一:样品的成分只有氢氧化钠。
猜想二:样品中除了氢氧化钠外,还含有碳酸钠。支持这种猜想的依据是________。
猜想三:该样品中除了氢氧化钠外,还含有氢氧化钙、碳酸钠和碳酸钙。
【实验与结论】验证猜想一:取少量固体样品放入水中,得到澄清溶液并滴入酚酞溶液,观察到溶液变红。由此得出的结论是猜想一正确。
(2)验证猜想二:请你帮助完成下列实验报告
【提出猜想】(1)猜想一:样品的成分只有氢氧化钠。
猜想二:样品中除了氢氧化钠外,还含有碳酸钠。支持这种猜想的依据是________。
猜想三:该样品中除了氢氧化钠外,还含有氢氧化钙、碳酸钠和碳酸钙。
【实验与结论】验证猜想一:取少量固体样品放入水中,得到澄清溶液并滴入酚酞溶液,观察到溶液变红。由此得出的结论是猜想一正确。
(2)验证猜想二:请你帮助完成下列实验报告

【反思与评价】(3)该小组同学通过反思实验过程,认为猜想一是不正确的,理由是____________。
(4)通过上述探究,他们认为提出的猜想三不可能存在。请你帮助分析理由:____________________。
(4)通过上述探究,他们认为提出的猜想三不可能存在。请你帮助分析理由:____________________。
(1)原料中的纯碱没有全部参加反应或氢氧化钠变质(答案合理即可)。
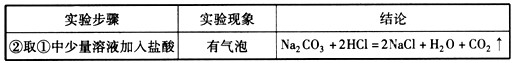
(2)
(3)碳酸钠溶液也呈碱性,也使酚酞溶液变红。
(4)氢氧化钙与碳酸钠不能共存;碳酸钙难溶于水,若含这种物质,就不会得到澄清溶液。
(2)

(3)碳酸钠溶液也呈碱性,也使酚酞溶液变红。
(4)氢氧化钙与碳酸钠不能共存;碳酸钙难溶于水,若含这种物质,就不会得到澄清溶液。

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
 在化工生产中,原料往往不能全部转化成产品.某校学生对买来的工业固体烧碱的杂质成分进行研究,他们查阅资料得知:在工业上用食盐和水配成饱和食盐水,通过电解(通电)制得烧碱溶液,再将溶液浓缩即可得到固体烧碱,通电过程中还可得到氢气和氯气(Cl2).他们推测该工业固体烧碱中可能含有碳酸钠、氯化钠,并设计了实验来验证假设.
在化工生产中,原料往往不能全部转化成产品.某校学生对买来的工业固体烧碱的杂质成分进行研究,他们查阅资料得知:在工业上用食盐和水配成饱和食盐水,通过电解(通电)制得烧碱溶液,再将溶液浓缩即可得到固体烧碱,通电过程中还可得到氢气和氯气(Cl2).他们推测该工业固体烧碱中可能含有碳酸钠、氯化钠,并设计了实验来验证假设.(1)请你帮助他们完成实验报告:
| 实验步骤 | 实验现象 | 结 论 |
| ①取样,加足量的水 | 固体完全溶解 | -- |
| ②用试管取上述试液,加入过量稀硝酸,塞上带导管的单孔塞;将导管的另一端插入 |
有 有 |
证明原固体烧碱中含有碳酸钠 |
| ③向试管中再加入硝酸银 | 有白色沉淀生成 | 证明原固体烧碱中含有 |
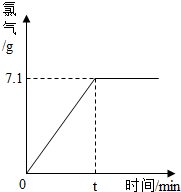
( 3 )现取100g室温下的饱和食盐水(此时质量分数约为26.5%)进行电解,当反应停止后,生成氯气的质量与时间的关系如图所示.请计算:参加反应的氯化钠的质量是多少?反应后所得烧碱溶液的质量分数是多少?(计算结果精确到0.001)

 (2013?丹徒区模拟)某校学生对买来的工业固体烧碱的杂质成分进行研究.
(2013?丹徒区模拟)某校学生对买来的工业固体烧碱的杂质成分进行研究.