题目内容
【题目】下图表示的是KNO3和NaNO3的溶解度曲线。下列说法正确的是
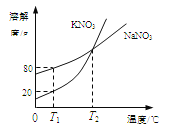
A.T2℃时,KNO3溶液的浓度一定等于NaNO3溶液的浓度
B.T1℃时,在50g水里加入15g KNO3固体,充分溶解,可得到65g溶液
C.T1℃时,往180g NaNO3饱和溶液中加入620g水可配成质量分数为10%的NaNO3溶液
D.若KNO3中混有少量NaNO3,可用蒸发溶剂的方法提纯
【答案】C
【解析】
试题分析:由溶解度曲线可知,T2℃时KNO3和NaNO3的溶解度相等,即该温度下的KNO3和NaNO3的饱和溶液中溶质的质量分数相等,A错误;T1℃时KNO3固体的溶解度为20g,即100g溶剂中只能溶解20g硝酸钾达到饱和状态,那么T1℃时,在50g水里加入15g KNO3固体,只能溶解10g,得到的溶液的质量为60g,B错误;溶液在稀释前后溶质的质量不变,T1℃时NaNO3的溶解度为80g,那么180g NaNO3饱和溶液中溶质的质量为80g,加入620g水后溶液的质量=180g+620g=800g,溶质的质量分数=80g/800g ×100%=10%,C正确;由溶解度曲线可知,硝酸钾的溶解度随温度的变化变化较大,要要用降温结晶的方法提纯,D错误。故选C。

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目