题目内容
【题目】(18分)为提高实验探究能力,某化学兴趣小组的同学在老师的指导下,对一瓶久置出现变质硬化的氢氧化钙固体进行如下探究活动。
【探究活动一】试验硬化的氢氧化钙样品是否完全变质
(1)用化学方程式表示氢氧化钙变质的原因: 。
(2)检验氢氧化钙样品是否完全变质,进行如下实验:
实验步骤 | 实验现象 | 实验结论 |
取氢氧化钙样品少量,研细后加适量蒸馏水 充分混合后静置, | 该样品还含有氢氧化钙 |
【探究活动二】测定样品中含有的变质固体(以下用R表示)的质量分数
取3克部分变质的氢氧化钙样品与足量的稀盐酸反应,测量生成气体的体积(气体不溶于植物油),从而计算出样品中R的质量,便可求出样品中R的质量分数。实验装置(气密性良好)如图1所示。
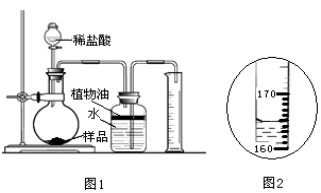
(3)将稀盐酸滴入样品中,产生气体的化学方程式为 ,反应一段时间后,当观察到 (填实验现象),才停止滴加稀盐酸。
(4)实验中量筒的作用是 。
(5)实验结束后,量筒内进入水的体积如图2所示,其读数为 mL。已知在该实验条件下,生成气体的密度为2g·L-1,通过计算,样品中R的质量分数为 。
(6)上述图1所示实验装置和相关试剂,用来实验测定样品中R的质量分数是比较粗略的,请简要说明测定数据存在误差的原因: (写一个)。
【答案】(1)Ca(OH)2+CO2===H2O+CaCO3↓(2)滴入几滴酚酞试液;酚酞试液变为红色
(3)CaCO3 + 2HCl==CaCl2 + CO2↑ + H2O;气泡不再产生(4)测量排出的水的体积
(5)165;25%(6)稀盐酸具有挥发性,产生的气体中可能混有氯化氢气体。
【解析】
试题分析:氢氧化钙变质的原因是因为氢氧化钙和空气中的二氧化碳反应产生碳酸钙沉淀,方程式为Ca(OH)2+CO2===H2O+CaCO3↓;是否完全变质,可以通过检验其中是否还含有氢氧化钙来完成,因此可以通过滴入酚酞试液,看颜色的变化,如果颜色还能变为红色说明其中还含有氢氧化钙;将稀盐酸滴入样品中,产生气体的化学方程式为CaCO3 + 2HCl==CaCl2 + CO2↑ + H2O;反应一段时间后,当观察到气泡不再产生,才停止滴加稀盐酸。实验中量筒的作用是测量排出的水的体积,排出水的体积就是产生的气体的体积;量筒内进入水的体积如图2所示,其读数为165ml;则生成二氧化碳的质量=0.165×2g·L-1=0.33克;设产生二氧化碳的质量为0.33克需要碳酸钙的质量为X。
CaCO3 + 2HCl==CaCl2 + CO2↑ + H2O
100 44
X 0.33克
列比例式得:100:X=44:0.33克 求得X=0.75克,样品中R的质量分数为=0.75克/3克×100%=25%
图1所示实验装置和相关试剂,用来实验测定样品中R的质量分数是比较粗略的,测定数据存在误差的原因稀盐酸具有挥发性,产生的气体中可能混有氯化氢气体,影响实验的结果。