��Ŀ����
����Ŀ���ᡢ����ڹ�ũҵ�������ճ����������Ź㷺Ӧ�á�
��1�������й��ᡢ��ε�˵������ȷ����_____��
A���������ƵĻ�ѧ���ʣ���Ϊ����Һ�ж�����H+
B�����к����⡢��Ԫ�أ����Ժ����⡢��Ԫ�صĻ����ﶼ�Ǽ�
C���кͷ�Ӧ�����κ�ˮ���������κ�ˮ�ķ�Ӧһ�����кͷ�Ӧ
D�������ɽ������Ӻ����������ɵģ�NaCl��û����������Բ�������
��2��������Ʒ����Ƹ���Cr�����Է�ֹ�����⣬��ҵ�ϻ�ȡ�Ƹ�ԭ�����������Ļ�ѧ��Ӧ����ʽΪ��Na2Cr2O7+X=2CrO3+Na2SO4+H2O������X�Ļ�ѧʽΪ_____��
��3��ʵ��С��̽��������������Ʒ�Ӧ��������ҺpH�ı仯���õ���ͼ��ʾ���ߡ�
���õιܵμӵ���Һ��_____
��д��C����Һ���������ʵĻ�ѧʽ_____
�۸�С��ͬѧ��̽�������з��������ݲ��������û�ѧ����ʽ���Ͳ������ݵ�ԭ��_____��_____
�������ʵ����֤ԭ����������Һ�Ѿ����ֱ���___________������д��ʵ�鲽�裩
��4������ͨ�����ԡ�±ˮ������ʽ����ȡ�����ģ�ij̽��С�������Ȼ��ƺ���������Ӧ���ⶨ±ˮ�е��Ȼ��ƺ�����ȡ±ˮ200g������200g��������Һʱ��ǡ����ȫ��Ӧ��±ˮ�������ɷݲ����跴Ӧ������÷�Ӧ����Һ����Ϊ256.5g�����±ˮ��NaCl����Ϊ����_______��

���𰸡�A��H2SO4������NaCl��HCl2NaOH+CO2=Na2CO3+H2O��Na2CO3+2HCl�T2NaCl+H2O+CO2��1��ȡ���������Թܣ������������Ȼ������Ȼ��Ƶȣ���Һ����������ɰ�ɫ������2�����ϲ���Һ�����̪��Һ����̪��Һ��졣���ۣ�ԭ����������Һ�Ѿ����ֱ��ʡ�58.5g��
��������
��1������������Լ��кͷ�Ӧ�����Ƚ��з�����
��2�����������غ㶨�ɷ����ͽ��
��3�����ݸ�����ͼ���з����ͽ��
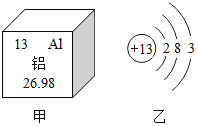
��4�����������غ㶨�ɿ�֪�������������ļ�������Ϊ�������Ȼ��������Կ��������Ȼ����������������Ȼ����������Ͷ�Ӧ�Ļ�ѧ����ʽ�����Ȼ��ơ�
��1��A���������ƵĻ�ѧ���ʣ���Ϊ����Һ�ж�����H+����ȷ��B�����к����⡢��Ԫ�أ����Ǻ����⡢��Ԫ�صĻ����ﲻһ���Ǽ��ˮ��H2O��������C���кͷ�Ӧ����ͼӦ�����κ�ˮ�������������κ�ˮ�ķ�Ӧ��һ������ͼӦ�����Բ�һ�����кͷ�Ӧ������D�������ɽ������Ӻ����������ɵģ�NaCl�к�����������������Ҳ������������ѡA��
��2����ҵ�ϻ�ȡ�Ƹ�ԭ�����������Ļ�ѧ��Ӧ����ʽΪ��Na2Cr2O7+X=2CrO3+Na2SO4+H2O����Ӧ����Crԭ��2����Oԭ��11����Hԭ��2����Sԭ��1����Naԭ��2������Ӧǰ����Crԭ��2����Oԭ��7����Naԭ��2����ȱ��Sԭ��1����Oԭ��4����Hԭ��2��������X�Ļ�ѧʽΪ H2SO4��
��3����������ҺpHԽ��ԽС�������ձ���ԭ��ҺΪ�������ƣ��õιܵμӵ���Һ��������
��C����ҺpHС��7����ʱ���������������������Ϊ���ɵ��Ȼ��ƺ�ʣ������ᣬ��Ӧ�Ļ�ѧʽ NaCl��HCl��
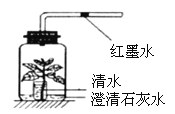
�۸�С��ͬѧ��̽�������з��������ݲ�����˵���������������˿����еĶ�����̼ת��Ϊ̼���ƣ�̼���ƺ����ᷴӦ�����˶�����̼����Ӧ�Ļ�ѧ����ʽΪ 2NaOH+CO2=Na2CO3+H2O��Na2CO3+2HCl�T2NaCl+H2O+CO2����
�����ʵ����֤ԭ����������Һ�Ѿ����ֱ��ʣ���Ҫ֤��̼���ƵĴ��ڣ���Ҫ֤���������ƵĴ��ڣ������в��ܲ������š�ʵ�鷽��Ϊ��1��ȡ���������Թܣ������������Ȼ������Ȼ��Ƶȣ���Һ����������ɰ�ɫ������2�����ϲ���Һ�����̪��Һ����̪��Һ��졣���ۣ�ԭ����������Һ�Ѿ����ֱ��ʡ���������Ψһ������������
��4�����������غ㶨�ɿɵã������Ȼ���������Ϊ200g+200g��256.5g=143.5g�����±ˮ��NaCl����Ϊx��
AgNO3+NaCl�TAgCl��+2NaNO3
58.5 143.5
x 143.5g
![]()
x=58.5g
�𣺸�±ˮ��NaCl����Ϊ58.5g��

����Ŀ�������ǵ���Ҫ�ɷ���̼��ƣ�Ϊ�ⶨ�������е�̼��ƺ�����ijͬѧ��������ϴ������ָ��ﲢ���飬չ��������̽����
��1����20mL������������Ϊ35%��Ũ�������Ƴ�10%��ϡ���ᣬ��������Ϊ��
����1������20ml������������Ϊ35%��Ũ���������Ϊ_____g����������������Ϊ35%��Ũ������ܶ���Ϊ1.2g/mL��
����2�������������ˮ�����Ϊ_____mL��
����3�����ݼ���������_____�ֱ���ȡ�����ˮ��Ũ���
����4������ȡˮ�����ձ��У�Ȼ����ȡŨ���ᵹ��ˮ�в��ò���������õ�ϡ���ᣮ
��2����ü����ǡ����ձ���������16g�����������ձ��У������Ƶ�ϡ����ȫ�����루������������ò�������ֽ��裬ʹ���ַ�Ӧ��ֱ�����ٲ�������Ϊֹ�����輦�����е��������ʲ���ϡ���ᷴӦ����ʵ�����ݼ�¼�������
�����ǵ����� | ���ձ������� | ��ַ�Ӧ���ձ���������������� |
16g | 60g | 155.6g |
��ʵ�������ɶ�����̼������Ϊ_____g��
�ڼ���ü�������̼��Ƶ���������________��