题目内容
某同学将15.0g碳酸钙粉末置于250mL、87.0g的烧杯中,向其中加入105.4g某浓度的稀盐酸,充分反应后,称得烧杯及其剩余物的总质量为203.0g。则:
(1)反应生成的二氧化碳的质量为________________g;(1分)
(2)烧杯内各物质的名称分别为_________ __________;(2分)
(3)列式计算所得溶液的溶质质量分数。(3分)
(1)反应生成的二氧化碳的质量为________________g;(1分)
(2)烧杯内各物质的名称分别为_________ __________;(2分)
(3)列式计算所得溶液的溶质质量分数。(3分)
(1)4.4g (2)碳酸钙、氯化钙、水 (3)10%
试题分析:
(1)该反应中只有二氧化碳是气体,则二氧化碳的质量为15.0g+87.0g+105.4g-203.0g=4.4g,故答案为:4.4g;
(2)烧杯中肯定有氯化钙、水这两种生成物,但由于题中没有明确指出“恰好完全反应”,所以还应考虑反应物有剩余的可能性。为此,我们通过生成4.4g二氧化碳,代入化学方程式可求得参加反应的碳酸钙的质量,从而判断碳酸钙是否有剩余。过程如下:
设参加反应的碳酸钙的质量为X
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
X 4.4g

X=10.0g
即碳酸钙有剩余,所以,烧杯中的物质有碳酸钙、氯化钙、水三种物质。
(3)所得溶液为氯化钙溶液,其质量分数为
 ,为此需先求得氯化钙溶质及氯化钙溶液的质量各是多少,再代入即得结果。过程如下:
,为此需先求得氯化钙溶质及氯化钙溶液的质量各是多少,再代入即得结果。过程如下:设生成的氯化钙的质量为Y
CaCO3+2HCl=CaCl2+H2O+CO2↑
111 44
Y 4.4g
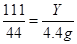
Y=11.1g
反应后溶液质量为10g+105.4g-4.4g=111g
所得溶液的溶质质量分数为:
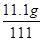 ×100%=10%
×100%=10%
练习册系列答案
 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
 4FeO+CO2↑.试计算应向160gFe2O3粉末中加入木炭粉的质量.
4FeO+CO2↑.试计算应向160gFe2O3粉末中加入木炭粉的质量.