题目内容
侯氏制碱法的步骤如下: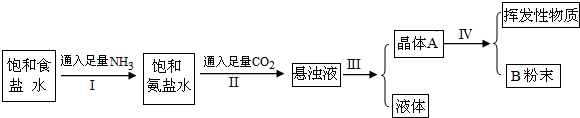
试回答下列问题:
(1)写出Ⅰ和Ⅱ的总反应的化学方程式为
(2)由此反应可知NaCl比NaHCO3溶解度
(3)操作Ⅰ、Ⅱ不能颠倒的原因是
(4)Ⅲ的操作叫
(5)Ⅳ的操作叫
(6)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶入水后,再滴加
分析:(1)根据反应物和生成物书写化学方程式;
(2)根据NaCl比NaHCO3存在状态判断溶解度大小;
(3)根据二氧化碳和氨气的溶解度来分析;
(4)根据所要分离物质的状态选择分离装置;
(5)根据晶体A的性质选择操作方法,书写化学方程式;
(6)根据氯离子的检验方法选择试剂.
(2)根据NaCl比NaHCO3存在状态判断溶解度大小;
(3)根据二氧化碳和氨气的溶解度来分析;
(4)根据所要分离物质的状态选择分离装置;
(5)根据晶体A的性质选择操作方法,书写化学方程式;
(6)根据氯离子的检验方法选择试剂.
解答:解:(1)由试验操作Ⅰ和Ⅱ可知,反应Ⅰ和Ⅱ的反应物为,氯化钠、二氧化碳、氨气和水,生成物为碳酸氢钠沉淀和氯化铵,总化学方程为:NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl
(2)氯化钠溶液中通入氨气、二氧化碳,析出碳酸氢钠晶体,说明氯化钠比碳酸氢铵的溶解度大;
(3)氨气极易溶于水,二氧化碳在水中的溶解度小,若操作Ⅰ和Ⅱ颠倒,会因CO2在水中溶解度小,会使NH3和CO2溶解量太小,生成的NaHCO3太少,而不能析出;
(4)Ⅲ的操作是为了分离出碳酸氢钠和氯化铵,碳酸氢钠为晶体,氯化铵溶解在水中,采用过滤的方法分离,晶体A为碳酸氢钠;
(5)碳酸氢钠不稳定,受热分解生成碳酸钠、二氧化碳和水,操作Ⅳ采用煅烧的方法来得到碳酸氢钠,化学方程式为:2NaHCO3
Na2CO3+CO2↑+H2O↑;
(6)要检验产品碳酸钠中是否含有氯化钠,实际上就是检验氯离子的存在,可先滴加过量稀硝酸,排除碳酸根离子的干扰,在滴加硝酸银溶液,如果有白色沉淀生成,则含有氯离子.
故答案为:
(1)NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl
(2)大
(3)若颠倒,因CO2在水中溶解度小,会使NH3和CO2溶解量太小,生成的NaHCO3太小,而不能析出
(4)过滤、碳酸氢钠
(5)煅烧 2NaHCO3
Na2CO3+CO2↑+H2O↑
(6)稀HNO3和AgNO3溶液
(2)氯化钠溶液中通入氨气、二氧化碳,析出碳酸氢钠晶体,说明氯化钠比碳酸氢铵的溶解度大;
(3)氨气极易溶于水,二氧化碳在水中的溶解度小,若操作Ⅰ和Ⅱ颠倒,会因CO2在水中溶解度小,会使NH3和CO2溶解量太小,生成的NaHCO3太少,而不能析出;
(4)Ⅲ的操作是为了分离出碳酸氢钠和氯化铵,碳酸氢钠为晶体,氯化铵溶解在水中,采用过滤的方法分离,晶体A为碳酸氢钠;
(5)碳酸氢钠不稳定,受热分解生成碳酸钠、二氧化碳和水,操作Ⅳ采用煅烧的方法来得到碳酸氢钠,化学方程式为:2NaHCO3
| ||
(6)要检验产品碳酸钠中是否含有氯化钠,实际上就是检验氯离子的存在,可先滴加过量稀硝酸,排除碳酸根离子的干扰,在滴加硝酸银溶液,如果有白色沉淀生成,则含有氯离子.
故答案为:
(1)NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl
(2)大
(3)若颠倒,因CO2在水中溶解度小,会使NH3和CO2溶解量太小,生成的NaHCO3太小,而不能析出
(4)过滤、碳酸氢钠
(5)煅烧 2NaHCO3
| ||
(6)稀HNO3和AgNO3溶液
点评:化学来源于生产、生活,又服务于生产、生活,氨碱工业是初中化学重要的应用之一,是考查重点,常涉及化学方程式的书写,二氧化碳和氨气的性质以及有关化学方程式的计算等.

练习册系列答案
相关题目
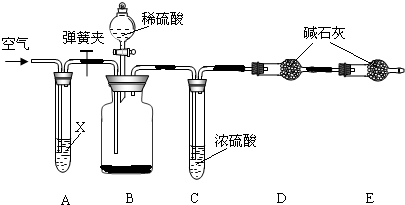
某同学在查阅资料时得知:市售纯碱样品常混有氯化钠杂质.
| 资料卡: 侯氏制碱法的原理可以表示为: NaCl+H2O+NH3+CO2 =NaHCO3↓+NH4Cl 2NaHCO3?Na2CO3+CO2 ↑+H2O该同学设计了如图中的装置进行实验,测定市售纯碱样品中碳酸钠的质量分数.(水蒸气的影响忽略不计,夹持装置已略去)  主要实验步骤如下: ①按图组装仪器,并检查装置的气密性; ②称量5.5g市售纯碱样品放入烧瓶中,加适量蒸馏水溶解,得到试样溶液; ③从分液漏斗滴入稀硫酸,直到不再产生气体时为止; ④缓缓鼓入一定量的N2; ⑤称量B瓶及溶液的质量,发现增重2.2g. 请回答下列问题: (1)写出A中发生反应的化学方程式 (2)鼓入一定量的N2的目的是 (3)如果将分液漏斗中的稀硫酸换成浓盐酸,测试的结果(填偏高、偏低或不变) (4)该样品中碳酸钠的质量分数为 (5)若用与上述实验反应原理不同的实验来测定纯碱样品中碳酸钠的质量分数,请用化学方程式表示实验原理 |