题目内容
【题目】实验探究一:课本第二单元课后作业中有“寻找新的催化剂” 的探究内容,实验中学探究小组据此设计了如下探究方案。
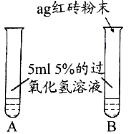
【提出问题】红砖粉末能否作为过氧化氢溶液分解的催化剂?如果能,效果如何?
【实验探究】
实验步骤 | 实验现象 | 实验结论及解释 |
Ⅰ. | A中无明显现象, B中产生大量能使带火星木条复燃的气体 | ① 产生的气体是______ ② 红砖粉末能改变过氧化氢分解速率 |
Ⅱ.向B试管中重新加入5%的过氧化氢溶液,反应停止后过滤、洗涤、干燥、称量滤渣 | ① 又产生大量能使带火星木条复燃的气体 ② 滤渣质量等于ag | 红砖粉末的_____在反应前后均没有发生变化,能作过氧化氢分解的催化剂 |
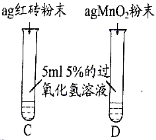
Ⅲ. | 两试管中均产生气泡且______ | 红砖粉末的催化效果没有二氧化锰粉末好 |
【拓展应用】
己知CuSO4也可作为过氧化氢分解的催化剂。向101.2g一定溶质质量分数的过氧化氢溶液中加入2g CuSO4粉末,充分反应后得到溶质质量分数为2%的溶液,则生成氧气_____g。
实验探究二:实验室中的试剂一般要密封保存,否则可能会与空气接触而变质。淅河中学化学学习小组发现一瓶未密封的氢氧化钾固体,对其是否变质进行探究。
【提出猜想】1.未变质 2.部分变质 3.完全变质
【查阅资料】KOH与NaOH性质类似,也能与CO2反应而变质。写出KOH变质的化学方程式为_____。
【设计实验】
(l)取少量样品于试管中配成溶液,滴加足量稀盐酸有气泡产生,则猜想_____不成立。
(2)准确称取一定质量的固体样品,放在右图所示装置中进行实验,根据CO2的体积和密度计算变质产物的质量,从而确定变质情况,你认为这个方案是否可行,并说明理由_________。
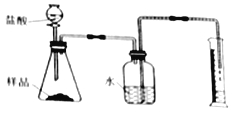
(3)请你另外设计一个方案,进一步探究变质情况
实验步骤 | 实验现象 | 实验结论 |
猜想2成立 |
【答案】探究一(4分):
实验步骤 | 实验现象 | 实验结论及解释 |
①氧气 | ||
化学性质和质量 | ||
C中产生气泡较慢 |
【拓展应用】3.2g
探究二(5分):
【查阅资料】2KOH+CO2=K2CO3+H2O
【设计实验】(l)l
(2)不可行,因为CO2能溶余水(或与水反应),导致测量结果误差较大。
(3)
实验步骤 | 实验现象 | 实验结论 |
另取少量样品,配成溶液滴加足量CuCl2溶液,静置后滴加酚酞溶液 | 产生白色沉淀 溶液变红色 | 猜想2成立 |
(说明:设计思路为先除尽CO32-,然后证明OH-存在。合理即可)
【解析】探究一过氧化氢在一定条件下分解生成氧气;催化剂在能改变其他物质的反应速率,而本身的质量和化学性质在反应前后不变。红砖粉末的催化效果没有二氧化锰粉末好,所以用红砖作催化剂的试管中生成氧气的速率较慢;【拓展应用】反应后所得溶液质量为2g÷2%=100g,据质量守恒定律可知反应前后物质的总质量不变,所以生成氧气的质量为101.2g+2g-100g=3.2g探究二: 【查阅资料】KOH与空气中的二氧化碳反应生成碳酸钾和水,变质的化学方程式为2KOH+CO2=K2CO3+H2O【设计实验】(l)碳酸钾和盐酸反应生成氯化钾、水、二氧化碳,氢氧化钾和盐酸不生成气体,所以向样品中,滴加足量稀盐酸有气泡产生,说明有碳酸钾,说明氢氧化钾变质;(2)因为CO2能溶于水(或与水反应),该方法测定的二氧化碳偏少,导致测量结果误差较大。(3)可利用碳酸钾转化成沉淀的方法测定碳酸钾,用氢氧化钾溶液呈碱性,能使酚酞试液变红。具体操作现象、结论是:另取少量样品,配成溶液滴加足量CaCl2溶液,静置后滴加酚酞溶液;产生白色沉淀 ,溶液变红色;(说明:设计思路为先除尽CO32-,然后证明OH-存在。合理即可)