题目内容
【题目】人类的生产生活离不开金属,因此为节约金属资源,某工厂欲从含有FeSO4和CuSO4的废液中回收金属铜,并得到工业原料硫酸亚铁,其工业流程如下:
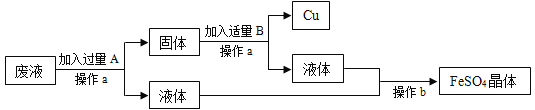
(1)操作a的名称是______;在操作b中需用玻璃棒不断搅拌,其作用是_________。
(2)请写出该流程中固体的成分____(写化学式),并写出加入过量A时反应的化学方程式:________________。
(3)铁制品生锈是金属资源损失的一大原因,这是由于铁与空气中的___________反应造成的。
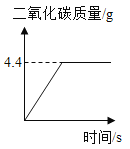
(4)某钢铁厂每天需消耗4900 t含Fe2O3 80%的赤铁矿石,该厂理论上可日产含Fe 98%的生铁的质量是____________t。
【答案】过滤 防止局部过热,液体飞溅 Fe、Cu ![]() H2O和O2 2800
H2O和O2 2800
【解析】
(1)固液分离操作是过滤,液体通过蒸发结晶得到晶体,操作b是蒸发结晶,蒸发时玻璃棒作用是,防止局部过热,液体飞溅,故填:过滤;防止局部过热,液体飞溅。
(2)FeSO4和CuSO4的废液中加入过量A,得到滤液是硫酸亚铁,故A是铁,铁和硫酸铜反应生成铜和硫酸亚铁,化学方程式![]() ,故固体是铜和铁,故填:Fe、Cu;
,故固体是铜和铁,故填:Fe、Cu;![]() 。
。
(3)铁制品生锈是金属资源损失的一大原因,主要是铁与空气中的H2O和O2反应造成的,故填:H2O和O2。
(4)设生铁质量为x,根据质量守恒反应前后元素质量不变,4900t×80%×![]() =x×98%,x=2800t,故填:2800。
=x×98%,x=2800t,故填:2800。

练习册系列答案
相关题目