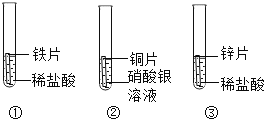
题目内容
【题目】我国有漫长的海岸线,海洋蕴藏着丰富的资源。请按要求填空。
(1)南海蕴藏着大量的可燃冰。可燃冰(主要成分是CH4)被科学家誉为未来能源,CH4完全燃烧的化学方程式是_____,可燃冰作为能源与煤、石油相比的优点是_____。
(2)海水淡化。日前能规模化和产业化淡化海水的方法主要是_____。
(3)从海水中得到金属镁。用苦卤制取金属镁的流程图如图所示:
![]()
①步骤1发生反应的化学方程式为_____。
②验证苦卤中MgCl2已完全转化为Mg(OH)2沉淀的方法是_____。
(4)海水制碱,流程图如图所示:
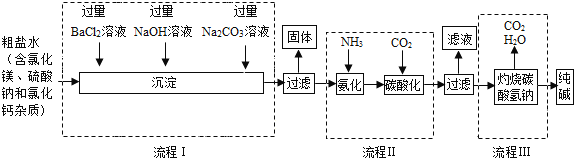
①该厂最终产品有_____(填物质名称)。
②流程中加入过量BaCl2溶液、NaOH溶液和Na2CO3溶液,除掉的离子分别是_____(填离子符号,注意顺序)。
③写出流程Ⅱ中发生反应的化学方程式_____。
【答案】CH4+2O2![]() CO2+2H2O 燃烧的产物是二氧化碳和水,污染小 渗透法或蒸馏法 Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2 取样品,加入氢氧化钙,观察是否会出现沉淀 纯碱 SO42-、Mg2+、Ca2+、Ba2+ NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3
CO2+2H2O 燃烧的产物是二氧化碳和水,污染小 渗透法或蒸馏法 Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2 取样品,加入氢氧化钙,观察是否会出现沉淀 纯碱 SO42-、Mg2+、Ca2+、Ba2+ NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3
【解析】
(1)甲烷和氧气在点燃的条件下生成水和二氧化碳,化学方程式为:CH4+2O2![]() CO2+2H2O,煤、石油燃烧时能够产生大量的二氧化硫、一氧化碳、氮氧化物等物质,这些物质是空气的主要污染物,而可燃冰燃烧的产物是水和二氧化碳,污染小;
CO2+2H2O,煤、石油燃烧时能够产生大量的二氧化硫、一氧化碳、氮氧化物等物质,这些物质是空气的主要污染物,而可燃冰燃烧的产物是水和二氧化碳,污染小;
(2)从海水中获取淡水,目前能规模化和产业化淡化海水的方法主要是渗透法或蒸馏法;
(3)①氢氧化钙和氯化镁反应生成氯化钙和氢氧化镁沉淀,化学方程式为:Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2;
②镁离子和氢氧根离子反应生成氢氧化镁沉淀,所以验证苦卤中MgCl2已完全转化为Mg(OH)2沉淀的方法是:取样品,加入氢氧化钙,观察是否会出现沉淀;
(4)①由反应流程图可知,得到的最终产物是纯碱;
②硫酸根离子和钡离子反应会生成硫酸钡沉淀,氢氧根离子和镁离子反应会生成氢氧化镁沉淀,碳酸根离子会与钙离子、钡离子反应生成碳酸钙、碳酸钡沉淀,所以流程中加入过量BaCl2溶液、NaOH溶液和Na2CO3溶液,除掉的离子分别是SO42-、Mg2+、Ca2+ Ba2+;
③氯化钠、氨气、二氧化碳和水反应生成氯化铵和碳酸氢钠,化学方程式为:NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3。

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案