题目内容
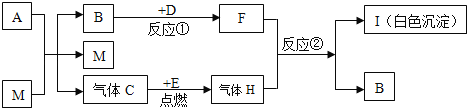
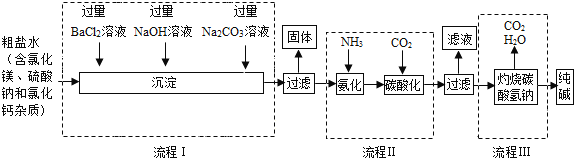
【题目】有一包白色固体样品,可能由硫酸钠、氢氧化钠、碳酸钙、氯化钡、氯化镁中的一种或几种物质组成,为探究该样品的组成,某小组取适量样品按下列流程进行实验。请回答下列问题:
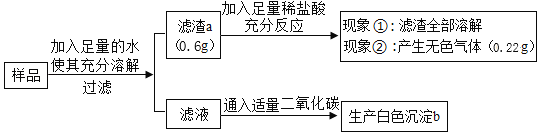
(1)滤渣a的成分是_____,滤液中溶质的成分一定有_____。
(2)若现象①“滤渣全部溶解”变为“滤渣部分溶解”,其它现象不变,则原样品中确定存在的物质是_____。(以上均写化学式)
【答案】CaCO3、Mg(OH)2 NaCl、MgCl2 MgCl2
【解析】
根据碳酸钙难溶于水,钡离子和硫酸根离子会生成硫酸钡沉淀,氢氧化钠和氯化镁反应会产生氢氧化镁沉淀,碳酸钙和盐酸反应会生成二氧化碳气体,结合化学方程式计算等知识进行分析。
解:(1)样品溶于水得到滤渣0.6g,能够全部溶于稀盐酸,且产生0.22g的二氧化碳,说明沉淀一定含有碳酸钙,一定没有硫酸钡;
设产生0.22g的二氧化碳需要碳酸钙的质量为x,
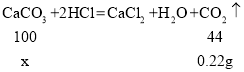
![]()
x=0.5g<0.6g,因此沉淀还有氢氧化镁,所以沉淀a是CaCO3、Mg(OH)2;
通过第二题分析可知,样品中一定含有碳酸钙,根据产生了0.22g无色气体,根据质量守恒定律计算可知,样品中碳酸钙的质量为0.5g,而实际滤渣有0.6g,所以样品中一定含有氯化镁与氢氧化钠,可能含有硫酸钠;因为滤液中通入二氧化碳能够生成白色沉淀,所以氯化镁一定过量,所以滤液中的溶质成分为:一定含有NaCl、MgCl2,可能含有硫酸钠;
(2)若现象①“滤渣全部溶解”变为“滤渣部分溶解”,其他现象不变,则原样品中不能确定是否存在的物质是MgCl2。

练习册系列答案
相关题目