题目内容
石灰石是山西省的主要矿物产品之一.研究性小组做了如下的实验.取50g石灰石样品(杂质不与酸或水反应)放入烧杯中,并加入稀盐酸217.6g,恰好反应完全.烧杯连同药品的质量(m)起始时为300g.实验数据记录如下:
(1)依据实验数据记录作出反应时间与生成C02质量关系的图象:
(2)从图象上可以得出三分钟产生的C02的质量为______g,M的值是______g;
(3)计算该石灰石中碳酸钙的质量分数;
(4)反应所得氯化钙溶液的溶质质量分数.
| 反应的时间(分) | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 |
| m(g) | 294.5 | 290.0 | 286.0 | 284.0 | 283.0 | 282.4 | M | 282.4 |

(2)从图象上可以得出三分钟产生的C02的质量为______g,M的值是______g;
(3)计算该石灰石中碳酸钙的质量分数;
(4)反应所得氯化钙溶液的溶质质量分数.
(1)由于反应后物质的减轻值为二氧化碳的质量,所以可得到不同时间的生成二氧化碳的质量,其对应关系如表所示:
利用描点法可得图象如图: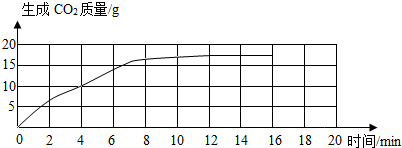
(2)从图象可知3分钟时生成的二氧化碳质量约为7.5g,12min和16min时的数据相同,说明12min时反应已完成,那么14 min时的数据应该和12min、16min时的一样,故表中M的值应该是282.4.
(2)最终反应生成二氧化碳的质量为:300.0g-282.4=17.6g
设石灰石样品中碳酸钙的质量为x氯化钙的质量是y.
CaCO3+2HCl═CaCl2+H2O+CO2↑
10011144
x y 17.6g
=
=
解之得:x=40g y=44.4g
∴石灰石样品中碳酸钙的质量分数为:
×100%=80%
反应后溶液的质量为:40g+217.6g-17.6g=240g,所以所得溶液的质量分数是
×100%=18.5%
故答案为:(1)如图:
(2)7.5;282.4;
(3)该石灰石中碳酸钙的质量分数为80%;
(4)反应所得氯化钙溶液的溶质质量分数为18.5%.
| 反应的时间(分) | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 |
| CO2(g) | 5.5 | 10 | 14 | 16 | 17 | 17.6 | 17.6 | 17.6 |

(2)从图象可知3分钟时生成的二氧化碳质量约为7.5g,12min和16min时的数据相同,说明12min时反应已完成,那么14 min时的数据应该和12min、16min时的一样,故表中M的值应该是282.4.
(2)最终反应生成二氧化碳的质量为:300.0g-282.4=17.6g
设石灰石样品中碳酸钙的质量为x氯化钙的质量是y.
CaCO3+2HCl═CaCl2+H2O+CO2↑
10011144
x y 17.6g
| 100 |
| x |
| 111 |
| y |
| 44 |
| 17.6g |
解之得:x=40g y=44.4g
∴石灰石样品中碳酸钙的质量分数为:
| 40g |
| 50g |
反应后溶液的质量为:40g+217.6g-17.6g=240g,所以所得溶液的质量分数是
| 44.4g |
| 240g |
故答案为:(1)如图:

(2)7.5;282.4;
(3)该石灰石中碳酸钙的质量分数为80%;
(4)反应所得氯化钙溶液的溶质质量分数为18.5%.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
