题目内容
(7分)老师从实验室带来了7瓶不同的无色溶液(如下图所示),其中3、7号试剂瓶标签完全破损,4、5号试剂瓶标签部分破损。根据查阅药品记录表可知,3、4、5、7号溶液分别是NaOH溶液、Na2CO3溶液、石灰水、CaCl2溶液中的一种。在老师的指导下,化学小组同学进行了下述实验。
(已知: Na2CO3溶液与CaCl2溶液能发生复分解反应)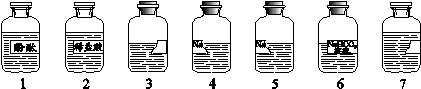
(1)分别取3、4、5、7号溶液于4支试管中,向其中分别滴加1号溶液,发现3、4、5号溶液变红,说明这3种溶液呈 (填“酸性”、“碱性”或“中性”)。由该实验可确定的溶液为 (写出试剂瓶编号及相应的溶液名称)。
(2)分别取4号、5号溶液于两支试管中,加入足量的2号溶液,发现均有气泡产生,
小组同学利用上述试剂,经过下述实验最终确定了两份溶液的成分。
| 实验操作及现象 | 实验结论 |
| | 4号溶液是Na2CO3溶液,5号溶液是变质的NaOH溶液。 |
(3)取3号溶液于试管中,逐滴加入一定量的6号溶液,观察到溶液变浑浊,过滤,则滤液中溶质的组成可能为NaOH;Na2CO3; (将其他情况补充完整)。
查阅资料可知:Ca(OH)2 + NaHCO3 CaCO3↓+ NaOH + H2O
NaOH + NaHCO3 Na2CO3 + H2O
(1)碱性 3号:石灰水;7号:CaCl2溶液(2)实验操作及现象:分别取适量4号、5号溶液于两支试管中,加入过量7号溶液,均产生白色沉淀,过滤,分别向滤液中滴入1号溶液,4号滤液无明显变化,5号滤液变成红色。NaOH+HCl===NaCl+ H2O; Na2CO3+2HCl===2NaCl+H2O+CO2↑
(3)NaOH、Ca(OH)2;Na2CO3、NaHCO3;NaOH、Na2CO3
解析试题分析:根据酸碱盐的性质可知(1)分别取3、4、5、7号溶液于4支试管中,向其中分别滴加1号溶液,发现3、4、5号溶液变红,说明这3种溶液呈碱性,由该实验可确定的溶液3号:石灰水;7号:CaCl2溶液;(2)实验操作及现象:分别取适量4号、5号溶液于两支试管中,加入过量7号溶液,均产生白色沉淀,过滤,分别向滤液中滴入1号溶液,4号滤液无明显变化,5号滤液变成红色。说明4号溶液是Na2CO3溶液,5号溶液是变质的NaOH溶液的结论;5号溶液中加入足量的2号溶液发生反应的化学方程式为NaOH+HCl===NaCl+ H2O; Na2CO3+2HCl===2NaCl+H2O+CO2↑(3)取3号溶液于试管中,逐滴加入一定量的6号溶液,观察到溶液变浑浊,过滤,则滤液中溶质的组成,根据物质的反应程度进行猜想为可能为NaOH;Na2CO3;NaOH、Ca(OH)2;Na2CO3、NaHCO3;NaOH、Na2CO3.
考点:溶液的鉴定、酸碱盐的性质

(9分) 一次趣味化学活动中,王老师向同学们展示了一瓶标签受损的无色溶液,如图所示。要求同学们进行探究:确认这瓶溶液究竟是什么溶液?
【提出猜想】 王老师提示:这瓶无色溶液只能是下列四种溶液中的一种:①硫酸镁溶液 ②硫酸钠溶液 ③硫酸溶液④硫酸铵溶液
【查阅资料】
①常温下,相关物质的溶解度如下:
| 物质 | MgSO4 | Na2SO4 | (NH4)2SO4 | H2SO4 |
| 溶解度 | 35.1g | 19.5g | 75.4g | 与水任意比互溶 |
【实验探究】(1)小明对王老师的提示进行了评价 ,原因是 。
(2)为确定其它几种猜想是否正确,小明同学继续进行探究:
| 实验操作 | 实验现象 | 实验结论 |
| ①取该溶液少许于试管中,向其中滴加几滴 溶液 | 溶液中有白色沉淀生成 | 猜想①成立 |
| ②用玻璃棒蘸取少许原溶液滴在pH试纸上,并跟标准比色卡对照 | 溶液pH小于7 | 猜想③成立 |
(3)请你设计实验方案,确认该溶液是硫酸铵溶液并完成实验报告:
| 实验操作 | 实验现象 | 实验结论 |
| 取该溶液少许于试管中, | | 猜想④成立,该反应的化学方程式为 |
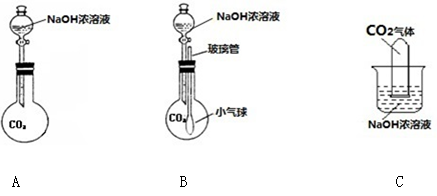
甲同学认为Ca(OH)2与CO2能反应,而NaOH与CO2不能反应,因为实验室检验CO2用
澄清石灰水而不用NaOH溶液。乙同学认为甲同学的说法不完全正确。乙同学怎么通过
实验证明自己的观点呢?请你与乙同学一起在实验室完成以下实验。
【提出假设】NaOH溶液与CO2能反应。
【设计方案】(1)常用 和 反应制取CO2气体;
(2)请从如图所示的实验装置中选出正确的制取装置 (填字母),不选择其它发生装置的理由是 。
(3)验证假设:
| 实验步骤 | 实验现象 | 结论 |
| 第一步:向集满CO2的塑料瓶中注入少量NaOH溶液,立即旋好盖子,振荡 | | NaOH溶液吸收了塑料瓶中的CO2气体 |
| 第二步:取上一步中所得溶液,加入盐酸 | | 有关反应的化学方程式为 |
(4)【总结与反思】丙同学认为还应该做一个对比实验,其理由是 。
(7分)有一包白色固体样品,可能是碳酸钠、硫酸钡、氢氧化钠、氯化钡中的一种或几种。为探究其成分,小燕老师取用一定量样品,加足量水溶解,过滤得到白色沉淀甲和无色滤液乙。
写出上述操作中可能发生反应的化学方程式: 。
过滤时用到玻璃棒,玻璃棒的作用是 。
【探究活动一】 奋进小组探究白色沉淀甲的成分。
| 实验操作 | 实验现象 | 结 论 |
| 取白色沉淀甲,滴加足量的稀硝酸 | 沉淀部分消失 | 白色沉淀甲中一定含有 |
| 实验操作 | 实验现象 | 结论 | |
| 实验Ⅰ | 取适量无色滤液乙,加入碳酸钠溶液 | 无明显现象 | 无色滤液乙中一定不含 |
| 实验Ⅱ | 步骤①:取适量无色滤液乙,加入过量的 溶液,过滤 | 生成白色沉淀 | 原白色固体样品中一定存在该物质 |
| 步骤②:取步骤①中的滤液,滴加 溶液 | | ||
【结论】 通过两个小组的共同探究,得出了原白色固体样品含有的成分。
(8分)(1)小方用下图所示装置对二氧化碳的灭火实验进行研究,
观察到的现象是____________________________________。
实验的结论是______________________________________。
(2)【提出问题】二氧化碳能否支持燃烧?
【猜想假设】镁能在二氧化碳中燃烧。
【查阅资料】①氧化镁、氢氧化镁均是白色难溶于水的固体。
②MgO+2HCl= MgCl2+H2O 、
③MgCl2+2NaOH=Mg(OH)2↓+2NaCl 。
【实验探究】
①下图中镁带剧烈燃烧,冒白烟,有黑色固体生成,并放出大量的热。
②为检验生成物的成分,做如下实验。
| 实验步骤 | 实验现象 | 实验结论和化学方程式 | |
| 向广口瓶中加入过量盐酸,充分反应后过滤,在滤纸上留有黑色固体。 | I、将黑色固体收集、洗涤、干燥后,点燃,在火焰上方罩一个蘸有澄清石灰水的烧杯。 | 黑色固体燃烧,烧杯内壁出现白色浑浊。 | 黑色固体是______; 反应的化学方程式是: ___________________。 |
| II、取少量滤液于试管中,逐滴加入氢氧化钠溶液。 | 开始_______,后有白色沉淀产生。 | 白烟的成分是______。 | |
③为了回收II中的白色沉淀,证明沉淀完全的实验方法是______________________
___________________________________(要求写出步骤、试剂、现象和结论)。
【反思提高】实验室中由某些活泼金属引起的着火,不能用二氧化碳灭火,应用细沙灭火。