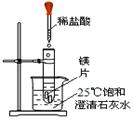
题目内容
(5分)小刚和小丽两位同学用下图所示装置进行实验,验证CO2与NaOH是否发生反应。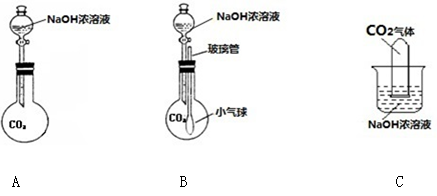
小刚用A装置未看到明显的现象,他认为CO2与NaOH不发生反应。
小丽用B装置进行实验,看到气球变鼓,认为CO2与NaOH发生反应,反应的方程式为_____________。
老师指出:CO2与水接触也能看到上述现象,因此上述实验不足以证明CO2与NaOH发生了反应,两位同学经过认真思考,决定从分液漏斗再向B烧瓶中加入足量的稀盐酸,又看到气球变瘪,从而确定CO2与NaOH发生了反应。解释气球变鼓的原因_________________,变瘪的原因_______________。
证明C中的CO2与NaOH溶液发生反应,两位同学认为利用该装置做个对比实验,补做的实验是:实验操作________________,实验现象___________。
(2)CO2+2NaOH ="=" Na2CO3+H2O , 二氧化碳与氢氧化钠发生反应瓶中压强减小,使气球鼓起; 稀盐酸与生成的碳酸钠反应生成二氧化碳,瓶中压强增大,使气球变瘪。
(3)将氢氧化钠溶液换成水,重复以上实验,观察到试管内液面上升的高度不相同。
解析试题分析:(2)CO2与NaOH反应会生成碳酸钠和水,反应的方程式为CO2+2NaOH ="=" Na2CO3+H2O 。反应会使装置内的二氧化碳气体减少,气压降低。所以会观察到气球在外界气压的作用下鼓起来。当再加入稀盐酸时,稀盐酸与碳酸钠反应生成二氧化碳气体。瓶内压强又变大,会观察到气球又变瘪。
(3)因为二氧化碳可溶于水,所以可增加二氧化碳与水在相同装置内的对比实验。如观察到水中的试管内液面上升的高度比氢氧化钠溶液中的低,则说明二氧化碳可与氢氧化钠反应。
考点:碱的化学性质、实验方案的设计与评价

 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案(11分)某实验小组的同学要探究酸碱盐中碳酸钠的化学性质,设计了如下实验装置及方案:
| 实验装置 | 实验步骤及操作 | 实验现象 |
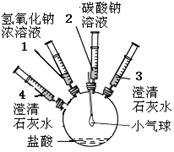 | ①将注射器2中的溶液推入盛有稀盐酸的瓶中,至不再有气泡产生。 | 气球变瘪 |
| ②将注射器3稍稍向外拉 | 澄清石灰水变浑浊 | |
| ③将注射器1中的溶液推入瓶中 | 气球鼓起 | |
| ④ | 无明显现象 | |
| ⑤将注射器4中的溶液推入瓶中 | |
(2)步骤①、②可得出碳酸钠具有 的性质;
(3)步骤④的操作是 ,其目的是 ;
(4)步骤⑤中发生反应的化学方程式 ;
(5)步骤③④⑤可得出碳酸钠具有 的性质;
(二)上述实验结束后,实验小组的同学又对瓶内溶液的成分十分好奇,进行了探究:
(1)【提出猜想】通过分析,一致认为瓶内溶液的溶质中一定含有 ,可能含有氢氧化钙或 。
(2)【实验验证】设计实验方案确定溶液中溶质的组成.
| 实验操作 | 实验现象 | 实验结论 |
| 分别取少量溶液于A、B两支试管中,A中 加入CaCl2溶液,B中加入Na2CO3溶液 | A中产生白色沉淀,B中没有沉淀 | 瓶内溶液中溶质的成分为 |
(3)【反思与交流】根据所学化学知识,除了以上方案外,下列哪些物质可以代替试管B中加入的Na2CO3溶液完成该实验? (填序号)
a.K2CO3 b.BaCO3 c.CO2 d.无色酚酞 e. CuSO4
(7分)老师从实验室带来了7瓶不同的无色溶液(如下图所示),其中3、7号试剂瓶标签完全破损,4、5号试剂瓶标签部分破损。根据查阅药品记录表可知,3、4、5、7号溶液分别是NaOH溶液、Na2CO3溶液、石灰水、CaCl2溶液中的一种。在老师的指导下,化学小组同学进行了下述实验。
(已知: Na2CO3溶液与CaCl2溶液能发生复分解反应)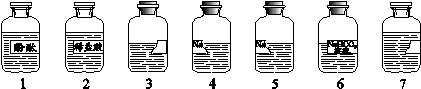
(1)分别取3、4、5、7号溶液于4支试管中,向其中分别滴加1号溶液,发现3、4、5号溶液变红,说明这3种溶液呈 (填“酸性”、“碱性”或“中性”)。由该实验可确定的溶液为 (写出试剂瓶编号及相应的溶液名称)。
(2)分别取4号、5号溶液于两支试管中,加入足量的2号溶液,发现均有气泡产生,
小组同学利用上述试剂,经过下述实验最终确定了两份溶液的成分。
| 实验操作及现象 | 实验结论 |
| | 4号溶液是Na2CO3溶液,5号溶液是变质的NaOH溶液。 |
(3)取3号溶液于试管中,逐滴加入一定量的6号溶液,观察到溶液变浑浊,过滤,则滤液中溶质的组成可能为NaOH;Na2CO3; (将其他情况补充完整)。
查阅资料可知:Ca(OH)2 + NaHCO3 CaCO3↓+ NaOH + H2O
NaOH + NaHCO3 Na2CO3 + H2O
(5.5分)为验证二氧化碳和氢氧化钠溶液确实能发生化学反应,两个化学兴趣小组的同学进行了如下探究活动。
⑴第一小组:小莉同学设计了如下图所示实验装置,集气瓶中充满二氧化碳气体,滴管中吸入了氢氧化钠溶液,集气瓶中的气球通过导气管与外界空气相通。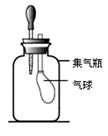
| 实验步骤 | 实验现象 | 实验结论 |
| 挤压滴管橡胶胶帽,使氢氧化钠溶液滴入集气瓶中。 | 气球逐渐变大 | 二氧化碳和氢氧化钠溶液确实发生了化学反应 |
⑵第二小组:小秦同学对实验装置做了如图改进。集气瓶中充满二氧化碳气体,气球通过导气管与外界空气相通,分液漏斗A中装有氢氧化钠溶液。分液漏斗B中装有另一种试剂。

步骤一:打开分液漏斗A的活塞,使氢氧化钠溶液流入集气瓶中。
现象:气球逐渐变大。
步骤二:打开分液漏斗B的活塞,使 溶液流入集气瓶中。
现象: ,产生这一现象的化学反应方程式是 。
结论:二氧化碳和氢氧化钠溶液可以反应,该反应的化学方程式是 。
⑶对于现象不明显的化学反应,上述两组同学的实验是分别从反应物和生成物两个方面进行的探究验证,其所利用的原理是不同的。
①第一组是通过实验证明 验证化学反应发生了;
②第二组是通过实验证明 验证化学反应发生了。
(8分)课外小组的同学上网查阅有关金属资料时,看到镁与饱和碳酸氢钠溶液反应能生成一种无色气体和一种白色不溶物。于是产生疑问:产生的气体和白色不溶物是什么物质?在老师的帮助下,他们进行了如下探究。
探究一 :产生的无色气体是什么物质?
| 实验序号 | 实验操作 | 实验现象 | 解释及结论 |
| 实验I | 用砂纸擦去镁条表面氧化膜,将其放入盛有适量饱和碳酸氢钠溶液的试管中 | 迅速反应,产生大量气泡和白色不溶物 |  |
| 实验Ⅱ | 将实验I中收集到的气体点燃,并在火焰上方罩一干、冷的小烧杯 | 气体安静燃烧、产生淡蓝色火焰,烧杯内壁有水雾出现。 | 该气体是 ,燃烧的化学方程式为 。 |
【查阅资料】
1.碱石灰是固体氢氧化钠和氧化钙的混合物。
2:MgCO3、Mg(OH)2加热易分解,分别生成两种氧化物。
【猜想与假设】
猜测1:白色不溶物可能为Mg(OH)2
猜测2:白色不溶物可能为MgCO3
猜测3:白色不溶物可能是Mg (OH)2和MgCO3的混合物
实验Ⅲ ①取洗净后的白色固体,加入足量的 溶液,观察到固体溶解,产生无色气泡,则白色固体一定含有 。(填名称)
②称取实验I中所得干燥、纯净的白色不溶物22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部通入装置A和B中。

实验后装置A增重1.8g,则白色固体中还含有 ,装置B增重8.8g,试确定白色不溶物中各成分的质量比为: 。
【实验反思】通过上述实验说明,对于未知物成分的确定,可以采取两种不同的实验方法,这两种方法分别是 , 。
(6分)某化学学习小组的同学在实验室将一定量氢氧化钙溶液与碳酸钠溶液于烧杯中充分反应。反应后溶液中的溶质是什么物质呢?大家围绕上述问题开展了下列探究活动,请你共同参与完成:
(1)氢氧化钙溶液与碳酸钠溶液反应的化学方程式为 。
(2)反应后溶液中的溶质是什么物质呢?
【猜想假设】猜想一:只有氢氧化钠
猜想二:是氢氧化钠和碳酸钠
猜想三:是 。
【实验探究】
| 实验步骤 | 实验现象 | 实验结论 |
| 步骤一:取少量溶液于试管中,滴加过量稀盐酸 | | 猜想二不正确 |
| 步骤二:取少量溶液于试管中,滴加 溶液 | 产生白色沉淀 | 猜想一不正确、猜想三正确 |
步骤二中小红认为选择另外一种不同类别的物质,也可得到同样的结论,则该物质的化学式为 。