题目内容
(6分)浓硫酸是重要的化工原料。试回答:
(1)一个硫酸分子(H2SO4)中含有 个原子。
(2)硫酸中氢、硫、氧三种元素的质量比为 。
(3)稀硫酸与其它酸都具有相似的性质是因为酸中都含有 。
(4)配制200g 24.5% 的稀硫酸需 98%的浓硫酸 g。
(5)为测定某氢氧化钠溶液的溶质质量分数,取25g该氢氧化钠溶液,滴加3—4滴酚酞,然后逐滴滴加上述24.5%的稀硫酸,待溶液由无色恰好变成无色时,测得共用去稀硫酸10g,则该氢氧化钠溶液的溶质质量分数为 。(写出计算过程)(2分)
(1)一个硫酸分子(H2SO4)中含有 个原子。
(2)硫酸中氢、硫、氧三种元素的质量比为 。
(3)稀硫酸与其它酸都具有相似的性质是因为酸中都含有 。
(4)配制200g 24.5% 的稀硫酸需 98%的浓硫酸 g。
(5)为测定某氢氧化钠溶液的溶质质量分数,取25g该氢氧化钠溶液,滴加3—4滴酚酞,然后逐滴滴加上述24.5%的稀硫酸,待溶液由无色恰好变成无色时,测得共用去稀硫酸10g,则该氢氧化钠溶液的溶质质量分数为 。(写出计算过程)(2分)
(1)7(2)2:32:64 (或1:16:32)(3)H+(或氢离子)(4)50 g;(5)8%
试题分析:
解:(1)由H2SO4可知一个硫酸分子(H2SO4)中含有的7个原子;
(2)由H2SO4可知硫酸中氢、硫、氧三种元素的质量比=(1×2):(32×1):(16×4)=1:16:32;
(3)稀硫酸与其它酸都具有相似的性质是因为酸中都含有氢离子(H+);
(4)设需98%的浓硫酸的质量为x。
200g×24.5%=98%·x
x=50g
答:需98%的浓硫酸的质量为50g。
(5)设25g该氢氧化钠溶液中氢氧化钠的质量为y。
H2SO4 +2NaOH═Na2SO4+2H2O
98 80
10g×24.5% y
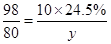
y=2g
该氢氧化钠溶液的溶质质量分数=
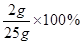 =8%
=8%答:该氢氧化钠溶液的溶质质量分数为8%。
故答案为:(1)7(2)2:32:64 (或1:16:32)(3)H+(或氢离子)(4)50 g;(5)8%
点评:本题主要考查学生利用化学方程式进行计算的能力;解题的关键是正确运用化学方程式;计算时要注意格式。

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目