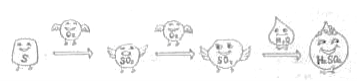
题目内容
【题目】已知一个C-12原子的质量为a kg,铝原子相对原子质量是27,该铝原子核内有13个质子,则下列关于该铝原子说法中不正确的是
A. 一个该铝原子的质量为2.25a kg B. 该铝原子形成的阴离子核外有13个电子
C. 该铝原子核内中子数是14 D. 该铝原子核带13个单位正电荷
【答案】B
【解析】
A、铝原子相对原子质量=![]() ,一个该铝原子的质量=
,一个该铝原子的质量= ![]()
![]() 铝原子相对原子质量=a kg
铝原子相对原子质量=a kg![]()
![]()
![]() 27=2.25a kg,故选项正确;B、铝原子失去最外层的3个电子形成阴离子,核外有10个电子,故选项错误;C、相对原子质量约等于质子数与中子数之和,故铝原子中的中子数=27-13=14,故选项正确;D、铝原子核内有13个质子,每个质子带一个单位的正电荷,铝原子核带13个单位正电荷,故选项正确。故选B。
27=2.25a kg,故选项正确;B、铝原子失去最外层的3个电子形成阴离子,核外有10个电子,故选项错误;C、相对原子质量约等于质子数与中子数之和,故铝原子中的中子数=27-13=14,故选项正确;D、铝原子核内有13个质子,每个质子带一个单位的正电荷,铝原子核带13个单位正电荷,故选项正确。故选B。

【题目】如图是汽车尾气中有害物质转化的微观示意图。
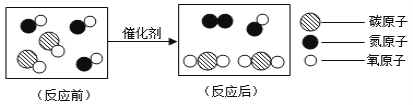
据图回答:
(1)该反应共涉及______种分子。
(2)写出该反应的化学方程式________。
(3)从图中你还能获取的微观信息是__________。
【题目】空气是人类最宝贵的自然资源。空气中氮气的含量最多,氮气在高温、高能量条件下可与某些物质发生反应。图1是以空气和其他必要的原料合成氮肥(NH4HCO3)的流程。请按要求回答下列问题:
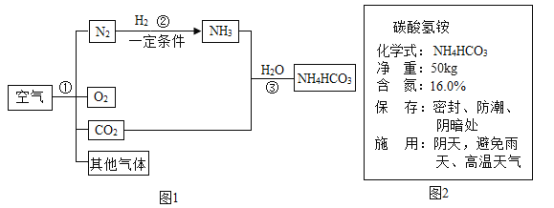
(1)步骤①中可利用氮气和氧气的_____不同分离出氮气和氧气,属于___变化。
(2)写出反应②的符号表达式:____________。
(3)图2是化肥碳酸氢铵包装袋上的部分说明:碳酸氢铵具有的性质是_________(填字母)。
A.易溶于水B.有挥发性 C.受热易分解
(4)这种化肥含氮量是否达到16%呢?带着这些问题,兴趣小组的同学取了一些化肥样品,进入实验室。
(查找资料)①碱石灰能够吸收H2O和CO2,但是不吸收NH3。
②浓硫酸能够吸收H2O和NH3,但是不吸收CO2。
(性质探究)该同学设计了如下的实验装置:
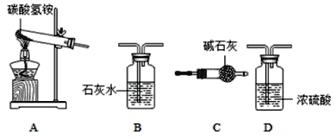
①用A装置给碳酸氢铵加热,装药品前,必须进行的一步操作是____________。
②取适量碳酸氢铵加入试管,连接A、B装置,加热,B中的现象是____________,B装置内发生反应的符号表达式为____________。
(含量分析)将装置A、C、D依次连接,加入20g化肥样品,加热至A中固体完全消失。
她称量装置D的质量如表:
实验前D装置的质量 | 149g |
实验后D装置的质量 | 152.4g |
③C装置的作用是__________。
④由表分析得知:反应中产生氨气的质量为_____g。
⑤通过反应的表达式可以知道:氨气中氮元素全部来自于碳酸氢铵(假设杂质中不含氮元素),请计算此化肥含氮元素的质量分数______________。(写计算过程)