题目内容
某化学兴趣小组的同学为了探究“复分解反应发生的条件”,做了两个实验:CuSO4溶液分别与NaOH溶液、BaCl2溶液反应.实验结束后将两实验中的废液倒入同一个干净的烧杯中,充分混合后过滤,得到滤液呈无色.
(1)写出废液混合后使滤液变无色时一定发生的反应的化学方程式:______.
(2)取少量滤液于试管中,滴入紫色石蕊试液,石蕊溶液仍为紫色,则滤液呈______性(填“酸”、“中”、“碱”).
(3)该小组的同学对滤液中溶质的成分继续进行了如下探究实验:
【提出问题】滤液中溶质的成分是什么?
【作出猜想】猜想Ⅰ:______;猜想Ⅱ______;猜想Ⅲ______.
【实验探究】
| 实验操作 | 实验现象 | 实验结论 |
| 实验①:取少量滤液于试管中,加入适量的纯碱溶液,振荡. | 无明显现象 | 猜想Ⅱ不成立 |
| 实验② ______ | 产生白色沉淀 | 猜想Ⅲ成立 |
【交流拓展】要使蓝色溶液变成无色,还可以用不同于上述原理的方法,即在蓝色溶液中加入足量的______.
解:(1)第一个反应:CuSO4溶液与NaOH溶液反应生成氢氧化铜沉淀和硫酸钠溶液,第二个反应:CuSO4溶液与BaCl2溶液反应生成硫酸钡沉淀和氯化铜,反应后废液中一定有氯化铜,废液混合后过滤所得滤液为无色,说明第一个反应中NaOH溶液过量,与氯化铜反应生成氢氧化铜沉淀和氯化钠,方程式是CuCl2+2NaOH=Cu(OH)2↓+2 NaCl;
(2)滴入紫色石蕊试液,石蕊溶液仍为紫色,说明溶液显中性;
【作出猜想】最终滤液无色,说明溶液中一定不含铜离子,滤液呈中性,说明氢氧化钠与氯化铜恰好反应,生成氯化钠,第一个反应生成硫酸钠溶液,所以滤液中的溶质可能是氯化钠和硫酸钠;
若第二个反应中氯化钡过量,则其废液中有氯化钡、氯化铜,若氯化钡与第一个反应生成的硫酸钠恰好反应,氢氧化钠与氯化铜恰好反应,则滤液中溶质为氯化钠;
若第二个反应中氯化钡过量,则其废液中有氯化钡、氯化铜,若氯化钡与第一个反应生成的硫酸钠反应后有剩余,氢氧化钠与氯化铜恰好反应,则滤液中溶质为氯化钠和氯化钡;
实验①:取少量滤液于试管中,加入适量的纯碱溶液,无现象,说明滤液中无钡离子,因为碳酸钠可与氯化钡反应生成碳酸钡沉淀,与氯化钠、硫酸钠不反应,则猜想Ⅱ是NaCl、BaCl2;
加入某物质能产生白色沉淀且最后溶液能使酚酞变红,说明是加入的碱性溶液,能与碱反应生成沉淀的是硫酸钠,碱与氯化钠不反应,所以猜想Ⅲ是NaCl、Na2SO4,猜想Ⅰ是NaCl;
【实验探究】硫酸钠可与氢氧化钡溶液反应生成硫酸钡沉淀,所以实验②可取少量滤液于试管中,加入适量的氢氧化钡溶液,振荡;
【交流拓展】锌排在铜前面,且反应后溶液为无色,故可选锌,铝、镁也可;
故答案为:(1)CuCl2+2NaOH=Cu(OH)2↓+2 NaCl;
(2)中;
【作出猜想】NaCl;NaCl、BaCl2;NaCl、Na2SO4;
【实验探究】取少量滤液于试管中,加入适量的氢氧化钡溶液,振荡;
【反思拓展】锌(合理均可).
分析:(1)碱、盐,盐、盐反应时反应物均须可溶,第一个反应:CuSO4溶液与NaOH溶液反应生成氢氧化铜沉淀和硫酸钠溶液,第二个反应:CuSO4溶液与BaCl2溶液反应生成硫酸钡沉淀和氯化铜,反应后废液中一定有氯化铜,废液混合后过滤所得滤液为无色,说明第一个反应中NaOH溶液过量,将氯化铜反应消耗完;
(2)滴入 紫色石蕊试液,石蕊溶液仍为紫色,说明溶液显中性;
【作出猜想】最终滤液无色,说明溶液中一定不含铜离子,滤液呈中性,说明氢氧化钠与氯化铜恰好反应,生成氯化钠,第一个反应生成硫酸钠溶液,所以滤液中的溶质可能是氯化钠和硫酸钠;
若第二个反应中氯化钡过量,则其废液中有氯化钡、氯化铜,若氯化钡与第一个反应生成的硫酸钠恰好反应,氢氧化钠与氯化铜恰好反应,则滤液中溶质为氯化钠;
若第二个反应中氯化钡过量,则其废液中有氯化钡、氯化铜,若氯化钡与第一个反应生成的硫酸钠反应后有剩余,氢氧化钠与氯化铜恰好反应,则滤液中溶质为氯化钠和氯化钡,再结合实验操作的现象和结论分析猜想的内容;
【实验探究】实验①:取少量滤液于试管中,加入适量的纯碱溶液,无现象,说明滤液中无钡离子,则猜想Ⅱ是NaCl、BaCl2;
加入某物质能产生白色沉淀且最后溶液能使酚酞变红,说明是加入的碱性溶液,能与碱反应生成沉淀的是硫酸钠,所以猜想Ⅲ是NaCl、Na2SO4,硫酸钠可与氢氧化钡溶液反应生成硫酸钡沉淀,据此分析解答;
【交流拓展】据前面的金属可将排在其后面的金属从其盐溶液中置换出来进行回答.
点评:本题主要考查了酸碱盐的化学性质,复分解反应条件的应用,以及应用知识分析和解决问题的能力,有一定难度,要依据物质间的反应细心分析解答.
(2)滴入紫色石蕊试液,石蕊溶液仍为紫色,说明溶液显中性;
【作出猜想】最终滤液无色,说明溶液中一定不含铜离子,滤液呈中性,说明氢氧化钠与氯化铜恰好反应,生成氯化钠,第一个反应生成硫酸钠溶液,所以滤液中的溶质可能是氯化钠和硫酸钠;
若第二个反应中氯化钡过量,则其废液中有氯化钡、氯化铜,若氯化钡与第一个反应生成的硫酸钠恰好反应,氢氧化钠与氯化铜恰好反应,则滤液中溶质为氯化钠;
若第二个反应中氯化钡过量,则其废液中有氯化钡、氯化铜,若氯化钡与第一个反应生成的硫酸钠反应后有剩余,氢氧化钠与氯化铜恰好反应,则滤液中溶质为氯化钠和氯化钡;
实验①:取少量滤液于试管中,加入适量的纯碱溶液,无现象,说明滤液中无钡离子,因为碳酸钠可与氯化钡反应生成碳酸钡沉淀,与氯化钠、硫酸钠不反应,则猜想Ⅱ是NaCl、BaCl2;
加入某物质能产生白色沉淀且最后溶液能使酚酞变红,说明是加入的碱性溶液,能与碱反应生成沉淀的是硫酸钠,碱与氯化钠不反应,所以猜想Ⅲ是NaCl、Na2SO4,猜想Ⅰ是NaCl;
【实验探究】硫酸钠可与氢氧化钡溶液反应生成硫酸钡沉淀,所以实验②可取少量滤液于试管中,加入适量的氢氧化钡溶液,振荡;
【交流拓展】锌排在铜前面,且反应后溶液为无色,故可选锌,铝、镁也可;
故答案为:(1)CuCl2+2NaOH=Cu(OH)2↓+2 NaCl;
(2)中;
【作出猜想】NaCl;NaCl、BaCl2;NaCl、Na2SO4;
【实验探究】取少量滤液于试管中,加入适量的氢氧化钡溶液,振荡;
【反思拓展】锌(合理均可).
分析:(1)碱、盐,盐、盐反应时反应物均须可溶,第一个反应:CuSO4溶液与NaOH溶液反应生成氢氧化铜沉淀和硫酸钠溶液,第二个反应:CuSO4溶液与BaCl2溶液反应生成硫酸钡沉淀和氯化铜,反应后废液中一定有氯化铜,废液混合后过滤所得滤液为无色,说明第一个反应中NaOH溶液过量,将氯化铜反应消耗完;
(2)滴入 紫色石蕊试液,石蕊溶液仍为紫色,说明溶液显中性;
【作出猜想】最终滤液无色,说明溶液中一定不含铜离子,滤液呈中性,说明氢氧化钠与氯化铜恰好反应,生成氯化钠,第一个反应生成硫酸钠溶液,所以滤液中的溶质可能是氯化钠和硫酸钠;
若第二个反应中氯化钡过量,则其废液中有氯化钡、氯化铜,若氯化钡与第一个反应生成的硫酸钠恰好反应,氢氧化钠与氯化铜恰好反应,则滤液中溶质为氯化钠;
若第二个反应中氯化钡过量,则其废液中有氯化钡、氯化铜,若氯化钡与第一个反应生成的硫酸钠反应后有剩余,氢氧化钠与氯化铜恰好反应,则滤液中溶质为氯化钠和氯化钡,再结合实验操作的现象和结论分析猜想的内容;
【实验探究】实验①:取少量滤液于试管中,加入适量的纯碱溶液,无现象,说明滤液中无钡离子,则猜想Ⅱ是NaCl、BaCl2;
加入某物质能产生白色沉淀且最后溶液能使酚酞变红,说明是加入的碱性溶液,能与碱反应生成沉淀的是硫酸钠,所以猜想Ⅲ是NaCl、Na2SO4,硫酸钠可与氢氧化钡溶液反应生成硫酸钡沉淀,据此分析解答;
【交流拓展】据前面的金属可将排在其后面的金属从其盐溶液中置换出来进行回答.
点评:本题主要考查了酸碱盐的化学性质,复分解反应条件的应用,以及应用知识分析和解决问题的能力,有一定难度,要依据物质间的反应细心分析解答.

练习册系列答案
相关题目
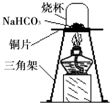 12、碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
12、碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.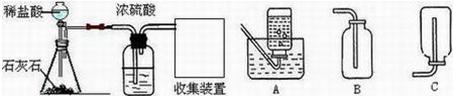
 (2012?烟台)某化学兴趣小组的同学用如图所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹.
(2012?烟台)某化学兴趣小组的同学用如图所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹. 某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.
某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.