题目内容
【题目】下列为实验室常用的实验装置,回答问题: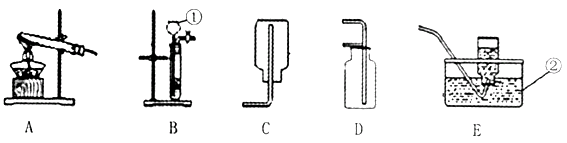
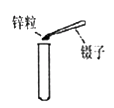
(1)写出带有标号仪器的名称:①;②。
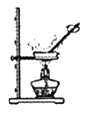
(2)用锌和稀硫酸制取氢气,应选用的发生装置是(填序号,下同) ,收集装置是。
(3)实验室常用稀盐酸和石灰石反应制CO2 , 该反应的化学方程式;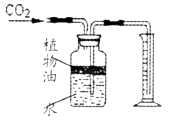
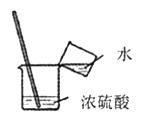
(4)上图所示装置可用来测量生成的CO2的体积,其中在水面上放一层植物油的目的是 , 植物油上方原有的空气对实验结果(填“有”或“无”)明显影响。
【答案】
(1)长颈漏斗,水槽
(2)B,C(或E,或CE也给分)
(3)CaCO3+2HCl=CaCl2+H2O+CO2↑
(4)防止二氧化碳溶于水且与水反应,无
【解析】(1)带有标号仪器的名称:①长颈漏斗;②水槽。
(2)由于常温下,用锌和稀硫酸反应制取氢气,不需要加热的固液反应,所以应选用的发生装置为B.由于制的氢气密度比空气小且难溶于水的性质,所以收集装置可以选取C或E。
(3)实验室常用稀盐酸和石灰石反应制CO2,该反应的化学方程式是CaCO3+2HCl=CaCl2+H2O+CO2↑。
(4)右图所示装置可用来测量生成的CO2的体积,其中在水面上放一层植物油的目的是防止二氧化碳溶于水且与水反应。植物油上方原有的空气对实验结果无明显影响。
所以答案是:(1)①长颈漏斗②集气瓶
(2)B;C(或E,或CE也给分)
(3)CaCO3+2HCl=CaCl2+CO2↑+H2O
(4)防止二氧化碳溶于水且与水反应;无

【题目】某校化学兴趣小组参观制碱厂后,获得以下信息井对相关问题进行研究。
【查阅资料】
①无水硫酸铜是白色固体,吸水变蓝。
②生产原料粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质。
③生产原理:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4C1。分离得晶体A,并使其充分受热,可分解制得纯碱及两种常见的氧化物。
④氯化铵分解的化学方程式是NH4Cl=NH3↑+HCl↑。
⑤部分生产流程如下图所示: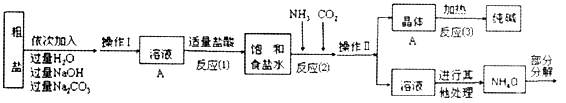
【问题讨论】
(1)①溶液A中的溶质有NaCl和、。
②操作Ⅱ的名称为。
③写出加入NaOH溶液所发生反应的化学方程式。
④流程中Na2CO3溶液的作用是除去粗盐中的。
(2)上述生产流程中可循环使用的是 (填序号)。
A.NH3
B.NaOH
C.HCl
D.CO2
(3)【组成探究】
①晶体A受热分解的化学方程式为 。
②设计实验检验纯碱样品中是否混有晶体A,请完成下表(从下列装置中选择):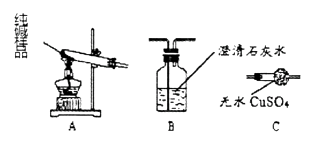
选择的装置 | 实验现象 | 实验结论 |
样品不含晶体A |
(4)【组成探究二】
取纯碱样品加水溶解,向该溶液中加入过量稀HNO3 , 再滴加AgNO3溶液,有白色沉淀。产生沉淀的方程式为 , 由此确定纯碱样品含有杂质NaCl。
(5)【组成探究三】
同学们为了测定该纯碱样品的纯度,设计了如下实验: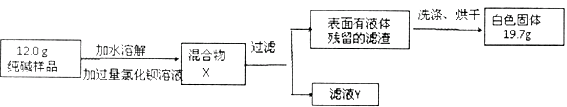
①氯化钡溶液过量的目的是。
②判断滤渣是否洗干净,可向最后的洗出液中滴加 , 然后观察现象判断。
A.氯化钡溶液 B.稀硫酸 C.稀盐酸 D.碳酸钾溶液
③根据实验数据,计算样品中碳酸钠的质量分数为。(精确到0. 1 % )
【题目】下列物质的性质与用途的对应关系错误的是( )
性质 | 用途 | |
A | 氯化钠易溶于水,水溶液有咸味 | 作调味品 |
B | 稀盐酸能与某些金属氧化物反应 | 除铁锈 |
C | 浓硫酸具有脱水性 | 干燥氧气 |
D | 氢氧化钠能与某些非金属氧化物反应 | 吸收二氧化硫 |
A.AB.BC.CD.D