��Ŀ����
����Ŀ��С����������ȤС��ͨ��ѧϰ�����ɵó�̼���ơ�̼�����ơ��������Ƶ�ˮ��Һ���Լ��ԣ����ǣ����Ƕ������������ᷴӦʱ����Ա仯����������̽����
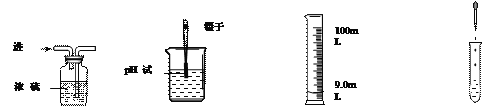
��������⣩���ǵ���Һ���ᷴӦʱ��Һ��pH��α仯��
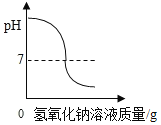
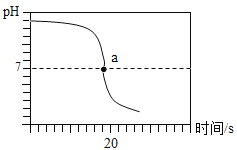
������ʵ�飩С��ͬѧ���ձ���Һ�м���Լ5mLϡ����������Һ�����뼸�η�̪��Һ����ʱ��Һ��_____ɫ��Ϊ______ɫ����μ���10%������Һ���÷�Ӧ�Ļ�ѧ����ʽΪ__________________________����Ӧʱ��ҺpH��ʱ��ı仯��ϵ��ͼ��ʾ��ͼ��a���ʾ�ĺ�����_______________________________��
��ʵ����������۽Ƕȷ������÷�Ӧ��ʵ����__________________________��
������ʵ�飩������������̼ԭ������̼�����ƺ�̼������Һ�У��ֱ���μ���10%������Һ���õ�pH��ʱ��ı仯��ϵ����ͼA��ͼB��ʾ��
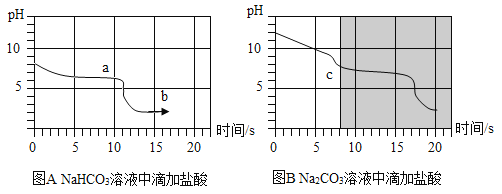
���������ۣ�b�������Ϊ__________��д��ѧʽ����ͬ������ͼA��ͼB����Ӱ���ֽ��е��ӣ������������غϣ�c��ʱ�����ᷴӦ��������________________��
��ʵ����չ��̽����Һ��pHֵ�ı仯��������ʶ��Ӧ��ԭ�������еĹ��̡�
���𰸡��� �� ![]() �������ƺ�����ǡ����ȫ��Ӧ �����Ӻ����������ӽ������ˮ���� NaCl�� HCl NaHCO3
�������ƺ�����ǡ����ȫ��Ӧ �����Ӻ����������ӽ������ˮ���� NaCl�� HCl NaHCO3
��������
�������ƺ����ᷴӦ�����Ȼ��ƺ�ˮ��̼�����ƺ�ϡ���ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼��̼���ƺ�ϡ���ᷴӦ������̼�����ƺ��Ȼ��ƣ�̼�������ٺ����ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼��
[����ʵ��]����ʹ��ɫ��̪��Һ���ɫ�����ձ���Һ�м���Լ5mLϡ����������Һ�����뼸�η�̪��Һ����Һ����ɫ��Ϊ��ɫ����μ���10%������Һ����Ӧ���������ƺ����ᷴӦ�����Ȼ��ƺ�ˮ����Ӧ�Ļ�ѧ����ʽΪ![]() ��ͼ��a��ʱpH=7����ʾ�ĺ������������ƺ�����ǡ����ȫ��Ӧ��
��ͼ��a��ʱpH=7����ʾ�ĺ������������ƺ�����ǡ����ȫ��Ӧ��
[ʵ�����]���۽Ƕȷ�������Ӧ��ʵ���������Ӻ����������ӽ������ˮ���ӡ�
[��������] ̼�����ƺ�ϡ���ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼��b��ʱϡ�����������������Ƿ�Ӧ���ɵ�NaCl������HCl����ͼA��ͼB����Ӱ���ֽ��е��ӣ������������غϣ�˵����̼������Һ�м���ϡ����ʱ��̼�����Ⱥ�ϡ���ᷴӦ����̼�����ƺ��Ȼ���,Ȼ��̼�������ٺ�ϡ���ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼����c��ʱ�����ᷴӦ��������̼�����ƣ���ѧʽΪNaHCO3��

����Ŀ���ᡢ�����������Ҫ���ʣ�
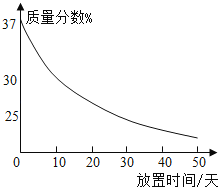
(1)ʵ��������һƿ���ڷ��õ�Ũ���ᣮ�������������ͷ��������Ĺ�ϵ��ͼ������ˮ������������Ũ������������������仯��ԭ��_____��
(2)�۲�ͼƬ����С�Թ��ڵμ�ˮ�����������ƹ����ܽ��⣬���ɹ۲쵽��������_____�����Ͳ����������ԭ��_____��_____��
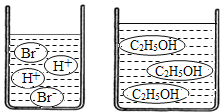
(3)��ͼ�ֱ����廯��(HBr)���Ҵ�(C2H5OH)��ˮ�е���ʾ��ͼ�����������е��ᡢ��֪ʶ���ж��廯���ˮ��Һ��_____���Ҵ���ˮ��Һ��_____(������������������������������)��
(4)��ʢ��10mLϡ����(���е�������ָʾ��)���ձ��м�������������Һ����pH�Ʋⶨ��Һ��pH�������������£���������ش��������⣺
����NaOH��Һ�����/mL | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 |
�ձ�����Һ��pH | 1.1 | 1.2 | 1.4 | 1.6 | 2.5 | 7.0 | 11.0 | 12.0 |
�����μӵ�ָʾ������ɫʯ����Һ������������������Һ�����Ϊ13mLʱ����Һ��_____ɫ��
�����μ�ָʾ������ɫ��̪��Һ��������������Һ�������Һ��ɫ�ޱ仯����ʱ��Һ�е�����һ����(�ѧʽ)_____��������_____��
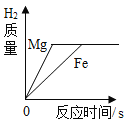
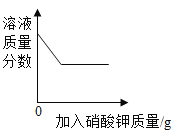
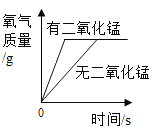
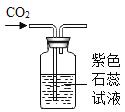
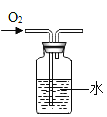
����Ŀ�������ĸ�ͼ���У�����ȷ��ӳ��Ӧ�仯��ϵ���� ( )
|
|
|
|
A������һ�����ĸ�����ع��� | B����������ȫ��ͬ�������У��ֱ������������ۺ�þ�� | C����ϡ�����еμ�����������Һ | D�����������ص����������뵽������ϡ������ |
A.AB.BC.CD.D