题目内容
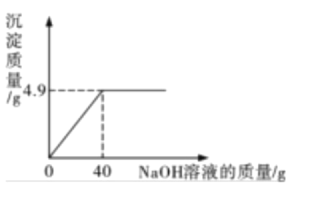
【题目】有一瓶标签被腐蚀的稀硫酸,为了测定溶液中溶质的质量分数,用NaOH固体和水配制40g溶质质量分数为10%的NaOH溶液于烧杯中,然后往烧杯中滴加该稀硫酸,反应过程中溶液的pH值与滴入稀硫酸的质量关系如图所示:
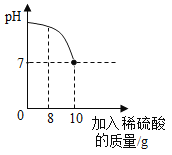
(1)A点溶液中溶质的成分为:_________。
(2)请计算该稀硫酸中H2SO4的质量分数_____________(写出计算过程)。
【答案】硫酸钠和氢氧化钠 24.5%
【解析】
(1)氢氧化钠与稀硫酸反应生成硫酸钠和水,A点时,pH>7,说明氢氧化钠尚未完全反应,故A点溶液中溶质的成分为:硫酸钠和氢氧化钠;
(2)B点时,pH=7,说明此时氢氧化钠和稀硫酸恰好完全反应,设该稀硫酸中H2SO4的质量分数为x
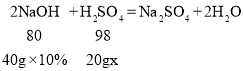
![]()
x=24.5%
答:该稀硫酸中H2SO4的质量分数为:24.5%。

练习册系列答案
相关题目
【题目】为测定镁和硫酸镁固体混合物中镁元素的质量分数,先称取混合物10g,放入一干净的烧杯中,然后取一定溶质质量分数的稀硫酸100g,平均分五次加入其中,充分振荡,实验所得数据如下表:
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
加入稀硫酸的质量/g | 20 | 20 | 20 | 20 | 20 |
生成气体的总质量/g | 0.12 | x | 0.36 | 0.4 | y |
(1)上表中x=_______、y=_______.
(2)固体混合物中镁元素的质量分数为__________.