题目内容
【题目】对比实验是学习化学的重要方法。请回答下列问题。
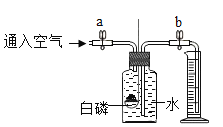
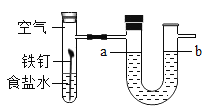
(1)实验一说明影响硫燃烧剧烈程度的因素是_____,该反应的化学方程式为____。
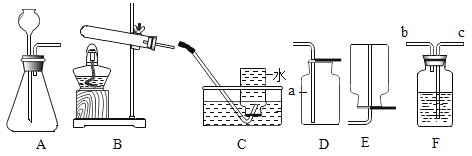
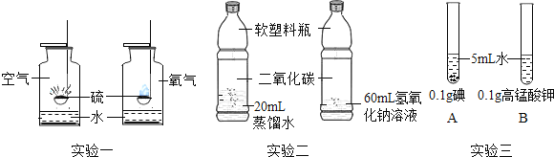
(2)实验二用于验证二氧化碳和氢氧化钠溶液能否反应,该实验设计不符合对比实验的基本原则,理由是______。
(3)实验三观察到A中固体几乎不溶,B中固体全部溶解,说明影响物质溶解性的因素是_______(填“温度”“溶质的性质”或“溶剂的性质”)。
【答案】氧气的浓度 S+O2![]() SO2 没有控制变量(或蒸馏水的体积和氢氧化钠溶液的体积不同) 溶质的性质。
SO2 没有控制变量(或蒸馏水的体积和氢氧化钠溶液的体积不同) 溶质的性质。
【解析】
(1)空气中氧气浓度低,燃烧不剧烈,纯氧中氧气浓度高燃烧剧烈,说明氧气浓度,影响硫燃烧剧烈程度,该反应化学方程式为S+O2![]() SO2,故填:氧气浓度;S+O2
SO2,故填:氧气浓度;S+O2![]() SO2。
SO2。
(2)实验二用于验证二氧化碳和氢氧化钠溶液能否反应,该实验设计不符合对比实验的基本原则,理由是没有控制变量(或蒸馏水的体积和氢氧化钠溶液的体积不同),故填:没有控制变量(或蒸馏水的体积和氢氧化钠溶液的体积不同)。
(3)实验三中AB溶质不同,观察到A中固体几乎不溶,B中固体全部溶解,说明影响物质溶解性的因素是溶质的性质,故填:溶质的性质。

 阅读快车系列答案
阅读快车系列答案【题目】用“盐酸—硫化钡法”生产BaCl2会放出有毒气体H2S(其水溶液呈酸性),可用NaOH吸收H2S制取Na2S进行处理。下表为H2S回收工艺的各项生产成本:
项目 | 单价(元/吨) |
NaOH | 6000 |
Na2S | 5000 |
辅助费用(以处理1吨H2S计) | 1114 |
(1)工业处理尾气需考虑经济效益和社会效益,根据上述资料分析,单从经济效益考虑,这种处理H2S的方法是______________(填“盈利”或“亏损”)的;
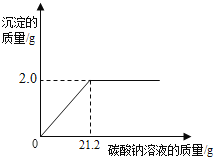
(2)“盐酸—硫化钡法”生产的BaCl2溶液中常会混有盐酸,为了测定该溶液中BaCl2的溶质质量分数,某同学做了如下实验:取该产品液10.0 g于烧杯中,逐滴滴入质量分数为5.3%的Na2CO3溶液至过量。记录滴入Na2CO3溶液的质量与有关量的变化关系如图1和图2所示:
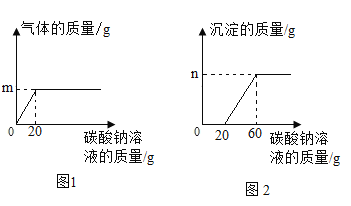
①m=________;n=________。
②与氯化钡反应的碳酸钠溶液的质量是________g。
③请计算该溶液中BaCl2的质量分数。(写出计算过程)