题目内容
【题目】(7分)某固体混合物A中可能含有Na2SO4、Na2CO3、Ba(NO3)2、NH4Cl物质中的一种或多种。按下图所示进行实验,出现的现象如图中所述(设过程中所有发生的反应都恰好完全反应)。
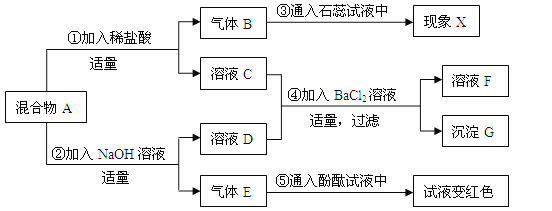
试根据实验过程和发生的现象做出判断,填写以下空白:
(1)现象X是__________,气体E的化学式为__________。
(2)固体混合物A中,肯定存在的物质是(写化学式)________________________________。
(3)写出步骤①中发生反应的化学方程式_____________________________________________。
(4)溶液F中,肯定存在的酸根离子是(写离子符号)______________。
(5)仅根据上述实验现象,固体混合物A中,还不能确定是否存在的物质是(写化学式)___________,要进一步推理混合物A的成分,可用沉淀G再实验,请简要说明实验操作步骤、发生的现象以及结论_____________________________________________________________________。
【答案】(1)变红; NH3
(2)Na2CO3、NH4Cl
(3)Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
(4)Cl_
(5)Na2SO4;取沉淀G少许,向其中加入足量稀硝酸,若沉淀全部溶解,则A中不含Na2SO4,若沉淀部分溶解,则A中含Na2SO4。
【解析】
试题分析:加入稀盐酸后会产生气体所以混合物中一定有碳酸钠,一定没有硝酸钡溶液,产生的二氧化碳会将石蕊溶液变为红色;加入氢氧化钠能产生气体说明混合物中一定含有氯化铵,产生的气体是氨气;反应1和反应2中得到的溶液都和氯化钡反应产生沉淀,说明混合物中含有硫酸根,或者含有碳酸根,因此不一定含有硫酸钠,同时说明F中的离子一定含有氯离子;仅根据上述实验现象,固体混合物A中,还不能确定是否存在的物质是硫酸钠,要进一步推理混合物A的成分,可将沉淀中加入硝酸,如果沉淀全部溶解,则A中不含Na2SO4,若沉淀部分溶解,则A中含Na2SO4。