题目内容
【题目】如图是A、B、C三种物质的溶解度曲线:
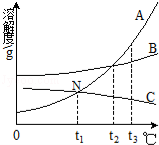
(1)t3℃时,A、B、C三种物质的溶解度从小到大的顺序是 ;
(2)温度由t3℃降至t2℃,溶解度减少最显著的是 ;
(3)t3℃时使三种物质的饱和溶液析出晶体,最佳方法分别是:A ,B ,C .
(4)N点表示 .
(5)A中含有少量B时,提纯A用
(6)当t3℃时A、B、C的饱和溶液降温到t1℃时,溶液的溶质质量分数大小比较是 .
【答案】(1)C<B<A;
(2)A;
(3)降温结晶法,蒸发溶剂法,升温结晶法;
(4)t1℃时,A、C的溶解度相等;
(5)降温结晶法;
(6)B>A>C.
【解析】
试题分析:根据固体物质的溶解度曲线可以:①比较不同物质在同一温度下的溶解度大小,②判断物质的溶解度随温度变化的变化情况,通过溶解度与温度的关系确定通过降温还是升温的方法使溶质从溶液中结晶析出.
解:
(1)由三物质的溶解度曲线可知,t3℃时,A、B、C三种物质的溶解度从小到大的顺序是:C<B<A;
(2)由于A的溶解度随温度的升高而增大,且受温度的影响最大,因此温度由t3℃降至t2℃,溶解度减少最显著的是A,故答案为:A;
(3)由于A的溶解度随温度的升高而增大,且受温度的影响最大,因此使A从饱和溶液中析出晶体,最好采用降温结晶的方法;而B的溶解度受温度的影响很小,因此使B从饱和溶液中析出晶体,最好采用蒸发溶剂的方法;而C的溶解度随温度的升高而减小,因此使C从饱和溶液中析出晶体,最好采用升高温度的方法;故答案为:降温结晶法,蒸发溶剂法,升温结晶法;
(4)由于在t1℃时,A和B的溶解度曲线交于N点,即两物质的溶解度相等,故答案为:t1℃时,A、C的溶解度相等;
(5)由于A的溶解度随温度的升高而增大,且受温度的影响最大,A中含有少量B时,提纯A用降温结晶法;
(6)AB的溶解度随温度降低而减小,C的溶解度随温度降低而增大,所以将t3℃时A、B、C三种物质的饱和溶液降温至t1℃时,AB析出晶体,溶质的质量分数减小,C的溶解度变大,溶质、溶剂的质量不变,所以溶质的质量分数与降温前相等;饱和溶液中溶质的质量分数的计算式![]() ×100%,可知溶解度大则溶质的质量分数大,而t1℃时B的溶解度大于A的溶解度大于t3℃时C的溶解度,所以此时A、B、C三种物质的溶液的溶质质量分数大小关系是B>A>C;
×100%,可知溶解度大则溶质的质量分数大,而t1℃时B的溶解度大于A的溶解度大于t3℃时C的溶解度,所以此时A、B、C三种物质的溶液的溶质质量分数大小关系是B>A>C;
答案:
(1)C<B<A;
(2)A;
(3)降温结晶法,蒸发溶剂法,升温结晶法;
(4)t1℃时,A、C的溶解度相等;
(5)降温结晶法;
(6)B>A>C.

 天天向上口算本系列答案
天天向上口算本系列答案