题目内容
【题目】某化工厂以生产氢氧化钠和氯气为主要产品。在通电的条件下发生的化学反应为:2NaCl + 2H2O=Cl2 ↑ + H2 ↑ + 2NaOH,所生产的氯气主要供给自来水厂做消毒剂。若自来水厂每天需氯气7.1吨。问:
(1)该厂每天至少需氯化钠固体多少吨?
(2)同时能生产质量分数为32%的氢氧化钠溶液多少吨?
【答案】(1)11.7t ; (2) 25t
【解析】
(1)根据氯气的质量求出消耗氯化钠的质量;(2)根据氯气的质量求出生成氢氧化钠的质量,从而求出氢氧化钠溶液的质量。
(1)设该厂每天至少需氯化钠固体的质量为x,同时能生产NaOH的质量为y。
2NaCl + 2H2O![]() Cl2 ↑ + H2 ↑ + 2NaOH
Cl2 ↑ + H2 ↑ + 2NaOH
117 71 80
x 7.1t y![]()
x=11.7t
y=8t
(2)生产质量分数为32%的氢氧化钠溶液的质量为8t÷32%=25t
答:(1)该厂每天至少需氯化钠固体11.7t;(2)同时能生产质量分数为32%的氢氧化钠溶液25t。

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
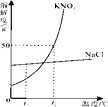
【题目】MgSO4和Na2CO3的溶解度表及溶解度曲线如下。下列说法错误的是
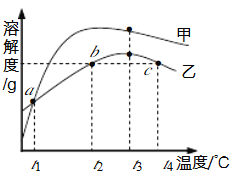
温度/℃ | 20 | 30 | 40 | 50 | 60 | 70 | 80 | |
溶解度 S/g | MgSO4 | 25.1 | 28.2 | 30..8 | 32.9 | 34.3 | 35.0 | 34.9 |
Na2CO3 | 21.5 | 39.7 | 49.0 | 48.5 | 46.0 | 45.2 | 43.9 | |
A. 甲为Na2CO3
B. 乙的饱和溶液从t1升温到t4,溶质质量分数增大
C. 等质量甲、乙饱和溶液从t3降温到t1,析出晶体的质量(不带结晶水):乙>甲
D. b、c点乙的饱和溶液溶质质量分数相等,且大于a点甲的饱和溶液溶质质量分数