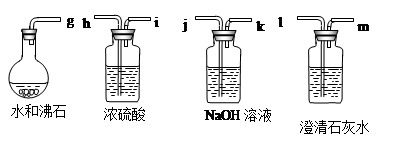题目内容
钢铁是使用最多的金属材料。
(1)铁制品锈蚀的过程,实际上是铁与 发生化学反应的过程。铝比铁活泼,但铝具有很好的抗腐蚀性能,其原因是 。
(2)将磁铁矿(主要成分是Fe3O4)冶炼成铁的化学方程式是 。生铁冶炼成钢的过程中,含碳量适当 (选填“升高”或“降低”)。
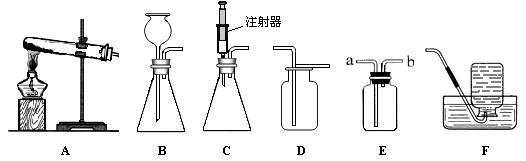
(3)实验室模拟炼铁原理进行实验,得到的尾气是CO和CO2的混合气体。现欲利用右图装置将该混合气体进行分离,图中a、b、c、d均为活塞。

①检查装置的气密性。
甲、乙、丙装置内放入一定量水,使长导管口浸没在水面以下,关闭b、c,打开a、d,并在最右端导管口接注射器。当向外缓慢拉动注射器活塞时,如果整套装置气密性良好,则能观察到的现象是 。
②分离CO和CO2的混合气体。
可供选择的试剂有:稀硫酸、浓硫酸、氢氧化钠溶液、澄清石灰水。
步骤Ⅰ:关闭b、c,打开a、d,缓缓通入混合气体,甲中发生反应的化学方程式为
;若乙装置中的现象是 ,说明甲装置中的反应是充分的;丙中试剂为 。通过此步实验,分离出的气体是 。
步骤Ⅱ:关闭 ,打开 ,让分液漏斗中的稀硫酸缓缓流下至不再产生气泡时,关闭b。通过此步实验,即可分离出另一种气体。
(4)铁元素可以形成3种氧化物,分别是FeO、Fe2O3和Fe3O4。取29g由铁和氧两种元素组成的固体样品,在高温时与足量CO充分反应,生成的气体被足量澄清石灰水吸收,得到50g沉淀。由此分析,原样品可能是 (选填字母)。
(1)铁制品锈蚀的过程,实际上是铁与 发生化学反应的过程。铝比铁活泼,但铝具有很好的抗腐蚀性能,其原因是 。
(2)将磁铁矿(主要成分是Fe3O4)冶炼成铁的化学方程式是 。生铁冶炼成钢的过程中,含碳量适当 (选填“升高”或“降低”)。
(3)实验室模拟炼铁原理进行实验,得到的尾气是CO和CO2的混合气体。现欲利用右图装置将该混合气体进行分离,图中a、b、c、d均为活塞。

①检查装置的气密性。
甲、乙、丙装置内放入一定量水,使长导管口浸没在水面以下,关闭b、c,打开a、d,并在最右端导管口接注射器。当向外缓慢拉动注射器活塞时,如果整套装置气密性良好,则能观察到的现象是 。
②分离CO和CO2的混合气体。
可供选择的试剂有:稀硫酸、浓硫酸、氢氧化钠溶液、澄清石灰水。
步骤Ⅰ:关闭b、c,打开a、d,缓缓通入混合气体,甲中发生反应的化学方程式为
;若乙装置中的现象是 ,说明甲装置中的反应是充分的;丙中试剂为 。通过此步实验,分离出的气体是 。
步骤Ⅱ:关闭 ,打开 ,让分液漏斗中的稀硫酸缓缓流下至不再产生气泡时,关闭b。通过此步实验,即可分离出另一种气体。
(4)铁元素可以形成3种氧化物,分别是FeO、Fe2O3和Fe3O4。取29g由铁和氧两种元素组成的固体样品,在高温时与足量CO充分反应,生成的气体被足量澄清石灰水吸收,得到50g沉淀。由此分析,原样品可能是 (选填字母)。
| A.Fe2O3 | B.Fe3O4 | C.FeO和Fe3O4的混合物 | D.Fe2O3和FeO的混合物 |
(1)空气中的氧气、水蒸气等
铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化
(2)4CO + Fe3O4高温3Fe + 4CO2 降低
(3)①甲、乙、丙装置内长导管口均有气泡冒出
②步骤Ⅰ:2NaOH + CO2 Na2CO3 + H2O 石灰水未变浑浊 浓硫酸 CO
步骤Ⅱ:a、d b、c
(4)BD
铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化
(2)4CO + Fe3O4高温3Fe + 4CO2 降低
(3)①甲、乙、丙装置内长导管口均有气泡冒出
②步骤Ⅰ:2NaOH + CO2 Na2CO3 + H2O 石灰水未变浑浊 浓硫酸 CO
步骤Ⅱ:a、d b、c
(4)BD
试题分析:(1)铁在空气中锈蚀,实际上是铁跟氧气和水共同作用的结果;铝在空气中易与氧气反应,在其表面生成一层致密的氧化铝薄膜,阻止了铝进一步被氧化,所以铝具有很好的抗腐蚀性能。
(2)将磁铁矿(主要成分是Fe3O4)冶炼成铁的过程,是一氧化碳与Fe3O4反应生成铁和二氧化碳的过程,故反应的化学方程式是4CO + Fe3O4高温3Fe + 4CO2;由于生铁的含碳量比钢的含碳量高,故生铁冶炼成钢的过程中,含碳量会降低。
(3)①装置气密性检查的原理是:通过气体发生器与附设的液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏;故向外拉活塞时广口瓶中气体体积增大,压强减小,外界大气压会迫使外边的空气通过a进入锥形瓶,再依次进入乙、丙,故可见甲、乙、丙装置内长导管口均有气泡冒出。
②由于本实验要分离CO和CO2的混合气体,故,
步骤Ⅰ:关闭b、c,打开a、d后,甲装置可装氢氧化钠溶液先把二氧化碳反应掉,方程式为2NaOH+CO2=Na2CO3+H2O;根据题意,乙装置是用来检验第一步是不是已经把二氧化碳完全吸了,故乙装置中应装澄清石灰水,且无浑浊现象发生,即说明甲装置中的反应是充分的;而丙装置是用来干燥CO气体的,故要用浓硫酸,实验后收集到的气体是一氧化碳。
步骤Ⅱ:由于步骤Ⅰ中二氧化碳与氢氧化钠溶液反应会生成了碳酸钠,故当分液漏斗中的稀硫酸缓缓流下后,会与碳酸钠反应再次生成二氧化碳,为防止二氧化碳被消耗,不应该让其通入到乙装置中,所以要关闭活塞a、d,打开活塞b、c。
(4)根据题意,铁的氧化物在高温时与足量CO充分反应,生成铁和二氧化碳,其中二氧化碳被足量澄清石灰水吸收,得到50g沉淀。故可通过沉淀的质量,结合二氧化碳与澄清石灰水反应的化学方程式,计算出反应生成的二氧化碳的质量,再根据二氧化碳的质量求出氧化物中氧元素的质量,从而得出铁、氧的质量比;最后根据三种氧化物中各自的铁、氧的质量比进行分析比较即可。
解,设铁的氧化物与足量CO反应生成的二氧化碳的质量为x
Ca(OH)2+CO2=CaCO3↓+H2O
44 100
x 50g
44:100=x:50g
解得,x=22g
根据题意可知,铁的氧化物被CO还原生成了铁,即氧化物的氧被CO夺去,由此可知,氧化物中的氧元素的质量=22g×
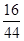 =8g,
=8g,则29g氧化物中的铁元素的质量=29g-8=21g,
即氧化物中的铁元素与氧元素的质量比=21:8
FeO中铁元素与氧元素的质量比=56:16=7:2=21:6,
Fe2O3中铁元素与氧元素的质量比=(56×2):(16×3)=7:3=21:9,
Fe3O4中铁元素与氧元素的质量比=(56×3):(16×4)=21:8,
故原样品可能是Fe3O4或Fe2O3和FeO的混合物。故选BD
点评:对于验证型实验探究,要熟记物质的性质或变化规律,根据给出的实验设计方案,进行实验、分析和探究,并通过观察、记录和分析的实验现象,来验证该物质的性质或变化规律等。在研究物质组成时,通过定性的探究实验不能确定某组成成分时,可通过定量研究加以判断;定量研究时,质量守恒思想是进行推断的根本依据。

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目