题目内容
 氢化锂(LiH)为玻璃状无色透明固体,军事上用作氢气发生来源.某化学兴趣小组取一定质量的氢化锂与99.4克水反应,产生气体的质量与反应时间的关系如图所示,请回答下列问题:
氢化锂(LiH)为玻璃状无色透明固体,军事上用作氢气发生来源.某化学兴趣小组取一定质量的氢化锂与99.4克水反应,产生气体的质量与反应时间的关系如图所示,请回答下列问题:
(1)氢化锂与水反应的化学方程式为:LiH+H2O=X+H2↑.则X的化学式为______;
(2)氢化锂中Li、H元素质量比为______;
(3)反应过程中生成氢气的质量为______g;
(4)取用氢化锂的质量为多少?
解:(1)由于化学反应前后各元素的原子种类及个数不变,所以LiH+H2O=X+H2↑反应前Li有1个原子、3个氢原子和1个氧原子,而反应后含有2个氢原子,所以X中一定含有1个锂原子、1个氢原子和一个氧原子,则X的化学式为:LiOH;
(2)氢化锂中Li、H元素质量比为7:1;
(3)由图象可知反应过程中生成氢气的质量为0.2g;
(4)设LiH的质量为x.
LiH+H2O=LiOH+H2↑
8 2
x 0.2g

x=0.8g
故答案为:(1)LiOH;(2)7:1;(3)0.2;(4)答:取用LiH的质量为0.8g.
分析:(1)依据质量守恒定律的应用解决问题即可;
(2)依据化学式中元素的质量比等于各元素相对原子质量和的比分析解答即可;
(3)分析图象数据进行解答;
(4)依据反应中生成氢气的质量利用氢化锂与水的反应方程式计算即可;
点评:解答此类问题的根本点在于化学式的计算和对反应图象的分析,明确曲线的折点常常表示此时恰好完全反应是解题的关键.
(2)氢化锂中Li、H元素质量比为7:1;
(3)由图象可知反应过程中生成氢气的质量为0.2g;
(4)设LiH的质量为x.
LiH+H2O=LiOH+H2↑
8 2
x 0.2g

x=0.8g
故答案为:(1)LiOH;(2)7:1;(3)0.2;(4)答:取用LiH的质量为0.8g.
分析:(1)依据质量守恒定律的应用解决问题即可;
(2)依据化学式中元素的质量比等于各元素相对原子质量和的比分析解答即可;
(3)分析图象数据进行解答;
(4)依据反应中生成氢气的质量利用氢化锂与水的反应方程式计算即可;
点评:解答此类问题的根本点在于化学式的计算和对反应图象的分析,明确曲线的折点常常表示此时恰好完全反应是解题的关键.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
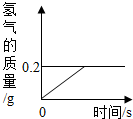 (2013?安庆二模)氢化锂(LiH)为玻璃状无色透明固体,军事上用作氢气发生来源.某化学兴趣小组取一定质量的氢化锂与水反应,得到100g氢氧化锂(LiOH)溶液,同时产生了氢气(LiH+H2O=LiOH+H2↑).产生氢气的质量与反应时间的关系如图所示,则所得氢氧化锂溶液的质量分数为多少?
(2013?安庆二模)氢化锂(LiH)为玻璃状无色透明固体,军事上用作氢气发生来源.某化学兴趣小组取一定质量的氢化锂与水反应,得到100g氢氧化锂(LiOH)溶液,同时产生了氢气(LiH+H2O=LiOH+H2↑).产生氢气的质量与反应时间的关系如图所示,则所得氢氧化锂溶液的质量分数为多少?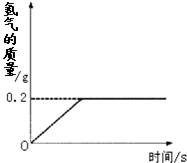 氢化锂(LiH)为玻璃状无色透明固体,军事上用作氢气发生来源.某化学兴趣小组取一定质量的氢化锂与99.4克水反应,产生气体的质量与反应时间的关系如图所示,请回答下列问题:
氢化锂(LiH)为玻璃状无色透明固体,军事上用作氢气发生来源.某化学兴趣小组取一定质量的氢化锂与99.4克水反应,产生气体的质量与反应时间的关系如图所示,请回答下列问题: LiOH + H2↑。计算80 g氢化锂与足量的水反应生成氢气的质量。
LiOH + H2↑。计算80 g氢化锂与足量的水反应生成氢气的质量。