题目内容
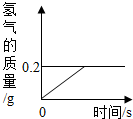 (2013?安庆二模)氢化锂(LiH)为玻璃状无色透明固体,军事上用作氢气发生来源.某化学兴趣小组取一定质量的氢化锂与水反应,得到100g氢氧化锂(LiOH)溶液,同时产生了氢气(LiH+H2O=LiOH+H2↑).产生氢气的质量与反应时间的关系如图所示,则所得氢氧化锂溶液的质量分数为多少?
(2013?安庆二模)氢化锂(LiH)为玻璃状无色透明固体,军事上用作氢气发生来源.某化学兴趣小组取一定质量的氢化锂与水反应,得到100g氢氧化锂(LiOH)溶液,同时产生了氢气(LiH+H2O=LiOH+H2↑).产生氢气的质量与反应时间的关系如图所示,则所得氢氧化锂溶液的质量分数为多少?分析:根据图中信息可以得出反应中生成氢气的质量,然后利用氢化锂与水的反应方程式计算出氢氧化锂的质量;进而结合溶液中溶质的质量分数进行计算即可.
解答:解:根据图中信息可以知道生成氢气的质量为0.2g
设反应得到氢氧化锂的质量为x
LiH+H2O═LiOH+H2↑
24 2
x 0.2g
=
解得:x=2.4g
所得氢氧化锂溶液的质量分数为:
×100%=2.4%
答:所得氢氧化锂溶液的质量分数为2.4%.
设反应得到氢氧化锂的质量为x
LiH+H2O═LiOH+H2↑
24 2
x 0.2g
| 24 |
| x |
| 2 |
| 0.2g |
解得:x=2.4g
所得氢氧化锂溶液的质量分数为:
| 2.4g |
| 100g |
答:所得氢氧化锂溶液的质量分数为2.4%.
点评:解答此类问题的根本点在于化学式的计算和对反应图象的分析,明确曲线的折点常常表示此时恰好完全反应是解题的关键.

练习册系列答案
相关题目