题目内容
氢化锂(LiH)为玻璃状无色透明固体,军事上用作氢气发生来源,反应的化学方程式为:LiH+H2O═LiOH+H2↑.据此计算:
(1)在LiH中,Li元素显+1价,则H元素显
(2)计算80g氢化锂与足量的水反应生成氢气的质量.
(1)在LiH中,Li元素显+1价,则H元素显
-1
-1
价.(2)计算80g氢化锂与足量的水反应生成氢气的质量.
分析:(1)依据化合物中各元素的化合价代数和为零分析解答;
(2)写出化学方程式并代入氢化锂的质量即可计算出氢气的质量.
(2)写出化学方程式并代入氢化锂的质量即可计算出氢气的质量.
解答:解:(1)由于化合物中各元素的化合价代数和为零,在LiH中Li为+1价,所以H元素的化合价为-1;
(2)设生成氢气的质量为x
LiH+H2O=LiOH+H2↑
8 2
80g x
=
x=20g
故答案为:(1)-1;(2)答:生成氢气的质量为20g;
(2)设生成氢气的质量为x
LiH+H2O=LiOH+H2↑
8 2
80g x
| 8 |
| 80g |
| 2 |
| x |
x=20g
故答案为:(1)-1;(2)答:生成氢气的质量为20g;
点评:此题主要是考查化学方程式和化合价知识,题型基础,重点是对相关基础知识的考查;

练习册系列答案
相关题目
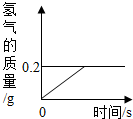 (2013?安庆二模)氢化锂(LiH)为玻璃状无色透明固体,军事上用作氢气发生来源.某化学兴趣小组取一定质量的氢化锂与水反应,得到100g氢氧化锂(LiOH)溶液,同时产生了氢气(LiH+H2O=LiOH+H2↑).产生氢气的质量与反应时间的关系如图所示,则所得氢氧化锂溶液的质量分数为多少?
(2013?安庆二模)氢化锂(LiH)为玻璃状无色透明固体,军事上用作氢气发生来源.某化学兴趣小组取一定质量的氢化锂与水反应,得到100g氢氧化锂(LiOH)溶液,同时产生了氢气(LiH+H2O=LiOH+H2↑).产生氢气的质量与反应时间的关系如图所示,则所得氢氧化锂溶液的质量分数为多少?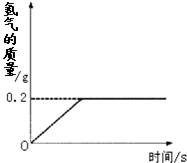 氢化锂(LiH)为玻璃状无色透明固体,军事上用作氢气发生来源.某化学兴趣小组取一定质量的氢化锂与99.4克水反应,产生气体的质量与反应时间的关系如图所示,请回答下列问题:
氢化锂(LiH)为玻璃状无色透明固体,军事上用作氢气发生来源.某化学兴趣小组取一定质量的氢化锂与99.4克水反应,产生气体的质量与反应时间的关系如图所示,请回答下列问题: LiOH + H2↑。计算80 g氢化锂与足量的水反应生成氢气的质量。
LiOH + H2↑。计算80 g氢化锂与足量的水反应生成氢气的质量。