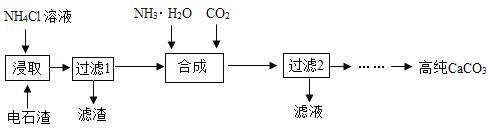
题目内容
【题目】为了测定某含杂质7%的黄铜样品中铜的质量分数(黄铜主要成分为铜和锌,并含有少量杂质。杂质中不含铜、锌元素,杂质不溶于水,不与其它物质反应,受热也不分解),某化学小组进行了如下实验:
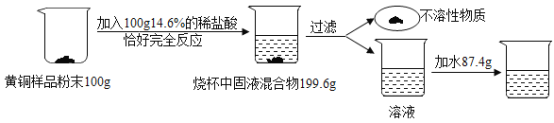
(1)该黄铜样品中铜的质量分数是多少________?
(2)向过滤后所得滤液中加入87.4g水,则最终所得溶液之中溶质的质量分数是多少________?
【答案】80% 13.6%
【解析】
(1)解:设该黄铜样品中锌的质量为X。
根据质量守恒定律,生成氢气的质量为:![]()


则样品中铜的质量分数为:![]()
答:该黄铜样品中铜的质量分数为80%。
(2)向过滤后所得滤液中加入87.4g水,则最终所得溶液之中溶质的质量分数是
解:设所得溶液中溶质的质量为Y。


所得溶液中溶质的质量分数为![]()
答:所得溶液中溶质的质量分数为13.6%。

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目