题目内容
在 pH=3的无色水溶液中可能大量存在的离子组是
- A.K+、Cu2+、Cl-
- B.K+、SO42-、Ba2+
- C.Cl-、Mg2+、Na+
- D.Cl-、CO32-、Na+
C
试题分析:A 无色水溶液说明溶液中不含有铜离子;B 硫酸根离子和钡离子生成硫酸钡沉淀,无法共存;D CO32-不能在pH=3的溶液中存在。
考点:离子共存
点评:离子共存问题属于中考的必考点,选择填空均可出题,考察形式较为灵活,注意积累总结。
试题分析:A 无色水溶液说明溶液中不含有铜离子;B 硫酸根离子和钡离子生成硫酸钡沉淀,无法共存;D CO32-不能在pH=3的溶液中存在。
考点:离子共存
点评:离子共存问题属于中考的必考点,选择填空均可出题,考察形式较为灵活,注意积累总结。

练习册系列答案
相关题目
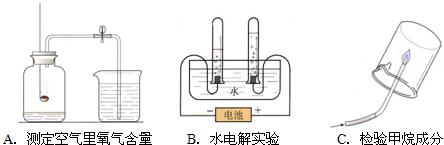
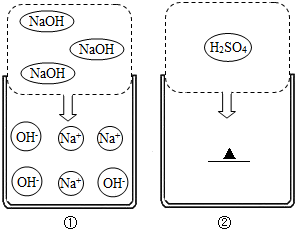
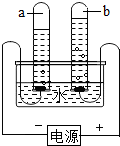
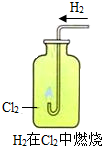
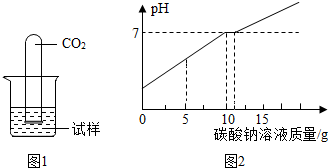
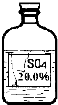 实验室有一瓶标签受损的无色溶液,如下图所示.老师要求同学们进行探究:这瓶溶液到底是什么溶液?
实验室有一瓶标签受损的无色溶液,如下图所示.老师要求同学们进行探究:这瓶溶液到底是什么溶液?