题目内容
(2010?天河区模拟)复习时,常用专题探究的方法学习常见物质的组成、性质与制取,课堂上老师引导我们回顾了几探究实验.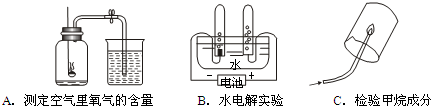
探究1:研究常见物质组成.
A、B、C都是研究物质组成的实验.从研究方法可知,A实验是利用可燃物消耗瓶内的
探究2:研究常见物质性质--氢氧化钠与硫酸是否刚好完全中和.
(1)探索:用玻璃棒蘸取反应后的溶液滴在pH试纸上,发现该溶液的pH<7,说明硫酸过量.
(2)验证:
写出(2)出中涉及的化学方程式
探究3:研究常见物质制取--制取氢氧化钠溶液.
小京同学向盛有澄清石灰水的烧杯中加入一定量的碳酸钠溶液,生成白色沉淀,过滤后得到无色溶液,他说:“我制得了氢氧化钠溶液!”
小欢同学却说:“这种无色溶液不一定就是氢氧化钠.”
根据小欢同学的质疑,你认为所得溶液中还可能含有
请你设计实验证明所得溶液中只有含氢氧化钠.

探究1:研究常见物质组成.
A、B、C都是研究物质组成的实验.从研究方法可知,A实验是利用可燃物消耗瓶内的
氧气
氧气
,使瓶内压强减小来推测空气里氧气含量的.B实验是通过证明生成物的元素种类(或组成或成分或氢气、氧气或H2、O2)
元素种类(或组成或成分或氢气、氧气或H2、O2)
来推断水的组成的.而C实验与B
B
(填实验代号)实验的方法相同.探究2:研究常见物质性质--氢氧化钠与硫酸是否刚好完全中和.
(1)探索:用玻璃棒蘸取反应后的溶液滴在pH试纸上,发现该溶液的pH<7,说明硫酸过量.
(2)验证:
| 实验内容 | 实验现象 | 解释与结论 |
| 取反应后少量溶液于试管中, 加入锌粒 加入锌粒 . |
有气泡产生 有气泡产生 |
证明硫酸过量 |
Zn+H2SO4═ZnSO4+H2↑
Zn+H2SO4═ZnSO4+H2↑
.探究3:研究常见物质制取--制取氢氧化钠溶液.
小京同学向盛有澄清石灰水的烧杯中加入一定量的碳酸钠溶液,生成白色沉淀,过滤后得到无色溶液,他说:“我制得了氢氧化钠溶液!”
小欢同学却说:“这种无色溶液不一定就是氢氧化钠.”
根据小欢同学的质疑,你认为所得溶液中还可能含有
碳酸钠
碳酸钠
或氢氧化钙
氢氧化钙
.请你设计实验证明所得溶液中只有含氢氧化钠.
| 实验步骤 | 实验现象 | 实验结论 |
①将所得溶液分成两等份分别放入两支试管中,向第一只试管溶液中加入Na2CO3溶液; ②向第二只试管溶液中加入氯化钙溶液 ①将所得溶液分成两等份分别放入两支试管中,向第一只试管溶液中加入Na2CO3溶液; ②向第二只试管溶液中加入氯化钙溶液 |
①无现象; ②无现象 ①无现象; ②无现象 |
①没有氢氧化钙;②没有碳酸钠; 所得溶液中只有含氢氧化钠 ①没有氢氧化钙;②没有碳酸钠; 所得溶液中只有含氢氧化钠 |
分析:探究一:这三个实验都是研究物质组成的实验,其中A实验是通过消耗氧气的体积来测定空气中氧气的含量,BC是通过生成物的组成来推断反应物的组成;
探究二:主要的验证酸的存在,根据酸的化学性质,可以选择金属,碱,盐等物质,只要有明显的现象就可以;
探究三:根据物质之间的反应进行分析,碳酸钠能与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,反应时存在物质过量的问题,碳酸钠和氢氧化钠的水溶液都呈碱性,要检验碳酸钠存在,可以加入含可溶性钙离子的物质且反应后不能生成氢氧化钠;检验氢氧化钙的存在可以滴加可溶性碳酸盐看是否产生沉淀进行解答.
探究二:主要的验证酸的存在,根据酸的化学性质,可以选择金属,碱,盐等物质,只要有明显的现象就可以;
探究三:根据物质之间的反应进行分析,碳酸钠能与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,反应时存在物质过量的问题,碳酸钠和氢氧化钠的水溶液都呈碱性,要检验碳酸钠存在,可以加入含可溶性钙离子的物质且反应后不能生成氢氧化钠;检验氢氧化钙的存在可以滴加可溶性碳酸盐看是否产生沉淀进行解答.
解答:解:探究一:A、B、C都是研究物质组成的实验.从研究方法得知,A实验是利用可燃物消耗瓶内的氧气,使瓶内压强减小来推测空气里氧气含量的.B实验是通过证明生成物的元素组成来推断水的组成的.而C实验与B实验的方法相同.
探究二:用玻璃棒蘸取反应后的溶液滴在pH试纸上,发现该溶液的pH<7,说明硫酸过量,验证酸过量的方法很多,根据酸的化学性质,可以用金属和酸反应,能放出气泡;可以和碱反应,不溶性碱能溶于酸;可以和盐反应,碳酸盐遇酸生成二氧化碳气体;
探究三:碳酸钠能与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,反应时存在物质过量的问题,所得溶液中还可能含有碳酸钠或者氢氧化钙;氢氧化钙的存在可以滴加可溶性碳酸盐看是否产生沉淀;碳酸钠和氢氧化钠的水溶液都呈碱性,要检验碳酸钠存在,可以加入含可溶性钙离子的物质看是否产生沉淀.
故答案为:
探究一:氧气;元素种类(或组成或成分或氢气、氧气或H2、O2);B
探究二:加入锌粒(或加入氧化铜或加入氢氧化铜或加入碳酸钠等其它合理答案也可);有气泡产生(或出现蓝色溶液或固体溶解,溶液变蓝或有气泡产生等);
Zn+H2SO4═ZnSO4+H2↑;
探究三:碳酸钠;氢氧化钙;
探究二:用玻璃棒蘸取反应后的溶液滴在pH试纸上,发现该溶液的pH<7,说明硫酸过量,验证酸过量的方法很多,根据酸的化学性质,可以用金属和酸反应,能放出气泡;可以和碱反应,不溶性碱能溶于酸;可以和盐反应,碳酸盐遇酸生成二氧化碳气体;
探究三:碳酸钠能与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,反应时存在物质过量的问题,所得溶液中还可能含有碳酸钠或者氢氧化钙;氢氧化钙的存在可以滴加可溶性碳酸盐看是否产生沉淀;碳酸钠和氢氧化钠的水溶液都呈碱性,要检验碳酸钠存在,可以加入含可溶性钙离子的物质看是否产生沉淀.
故答案为:
探究一:氧气;元素种类(或组成或成分或氢气、氧气或H2、O2);B
探究二:加入锌粒(或加入氧化铜或加入氢氧化铜或加入碳酸钠等其它合理答案也可);有气泡产生(或出现蓝色溶液或固体溶解,溶液变蓝或有气泡产生等);
| 实验内容 | 实验现象 | 解释与结论 |
| 加入锌粒 | 有气泡产生 | 证明硫酸过量 |
探究三:碳酸钠;氢氧化钙;
| 实验步骤 | 实验现象 | 解释与结论 |
| ①将所得溶液分成两等份分别放入两支试管中,向第一只试管溶液中加入Na2CO3溶液; ②向第二只试管溶液中加入氯化钙溶液 |
①无现象; ②无现象 |
①没有氢氧化钙;②没有碳酸钠; 所得溶液中只有含氢氧化钠 |
点评:本题为综合的实验探究题,我们应保持清晰的思路,认真研读题干中的信息,并联系相关物质的性质特别是化学性质来解答题目.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目