题目内容
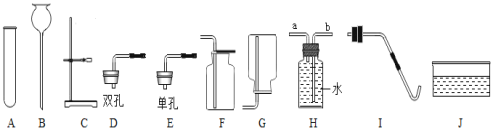
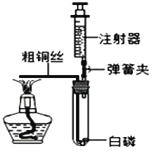
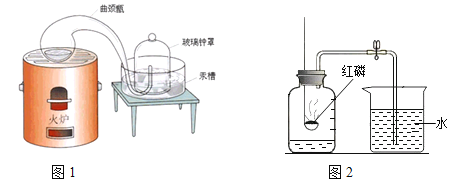
【题目】某兴趣活动小组的同学们按图1装置对“可燃物燃烧的条件”进行探究。探究过程中,大家对磷燃烧生成的大量白烟是否危害人体健康提出疑问。
(查阅资料)白磷的着火点是40℃,红磷的着火点是240℃,燃烧产物五氧化二磷是白色固体,会刺激人体呼吸道,可能与空气中水蒸气反应,生成有毒的偏磷酸(HPO3)。
(变流与讨论)白烟对人体健康有害,该实验装置必须改进。
(改进与实验)同学们按改进后的图2装置进行实验。
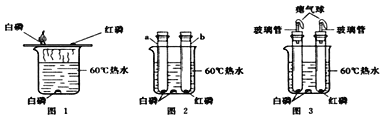
请你帮助他们将下表补充完整。
现象 | 解释 |
a试管中白磷燃烧,热水中白磷没有燃烧。 b试管中红磷没有燃烧。 | 热水中白磷没有燃烧的原因①______; b试管中红磷没有燃烧的原因②_____ |
(反思与评价) (1)改进后的图2装置与图1装置比较,优点是________。
(2)小林同学指出图2装置仍有不足之处,并设计了图3装置,其中气球的作用是___。
【答案】没有与氧气接触 温度没有达到着火点 不会污染空气 调节装置的体积,防止橡皮塞弹出
【解析】
[改进与实验]燃烧的条件是温度达到可燃物的着火点、可燃物与氧气接触。热水中白磷没有燃烧的原因是白磷没有与氧气接触。b试管中红磷的温度低于其着火点,所以没有燃烧。[反思与评价](1)改进后的图2装置与图1装置比较,优点是反应在密闭容器中进行,不会污染空气。(2)图3装置中气球的作用是调节装置的体积,防止橡皮塞弹出。

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案【题目】过氧化氢在生产生活中有广泛应用,实验小组对过氧化氢进行探究。
(一)探究过氧化氢制取氧气
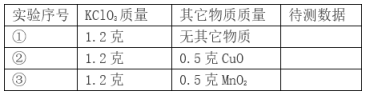
(1)分液漏斗中应放入的物质是_______,锥形瓶中应放入的物质是_______。写出该反应的符号达式__________________________,基本反应类型是_______。
(2)与高锰酸钾加热制取氧气相比,此法优点是_______(填编号)。
① 生成物只有氧气 ② 不需加热 ③ 更环保
(二)微观探究:如图是过氧化氢分解的微观示意图,据图回答:
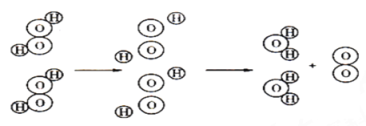
(3)一个过氧化氢分子由__________和____________构成。根据上图可以得出,在化学变化中__________可以再分,而________不能再分。
(三)不稳定性探究:探究温度对过氧化氢分解速率的影响。
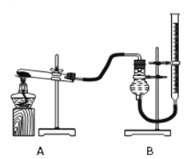
晓晓为了探究温度对H2O2分解速率的影响,利用如图所示装置(夹持装置略去)进行实验(水浴是利用热水进行加热),实验数据如下表:
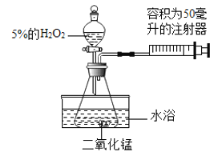
实验1 | 实验2 | |
MnO2的质量/克 | 0.5 | 0.5 |
5%的H2O2的体积/毫升 | 40 | X |
温度/℃ | 20 | 80 |
(4)实验2中X的值应为_______毫升。
(5)实验中可通过___________________________来比较H2O2分解速率的大小。
(6)实验2中水浴温度控制在80℃时,测定的反应速率会比真实值偏大,其原因是_______。
A.锥形瓶内气体受热膨胀 b.收集到的氧气中混有空气
C.温度较高时水蒸发成水蒸气 d.生成更多的氧气
(7)实验结束后若要将MnO2从混合物中分离出来,可采取的方法是_______、洗涤、干燥。
【题目】二百多年前,法国化学家拉瓦锡用图1装置定量的研究了空气的成分。仿照这个历史上著名实验的原理,用图2所示装置来测定空气中氧气的含量。
(实验回顾)图2是实验室用红磷燃烧来粗略测定空气中氧气含量的装置。写出红磷燃烧的符号表达式____。此实验不仅可以测定氧气占空气的体积分数,还可以说明氮气具有的化学性质是______(只需写一点)。
(分析讨论)用红磷燃烧的方法测出的氧气含量总是低于21%,有没有其他物质可以代替红磷进行实验而使实验结果更准确呢?
(实验改进1)同学们用蜡烛代替红磷测定空气中氧气的含量,发现蜡烛很快熄灭,回流到集气瓶中的水远远小于瓶中气体体积的1/5。是什么原因所致呢?
(猜想与假设)猜想①:蜡烛燃烧产生CO2气体;猜想②:__________。
(实验验证)将蜡烛点燃后用氧气传感器定量测定瓶中的氧气含量,数据如图3。

(得出结论)空气中氧气体积分数降低了______%。
(查阅资料)在老师的指导下,同学们查阅了红磷、白磷、蜡烛等可燃物燃烧所需要的最低含氧量以及其他信息如下:
资料1:
可燃物名称 | 红磷 | 白磷 | 蜡烛 |
最低含氧量/% | 8.0 | 4.0 | 16.0 |
甲、乙、丙三个小组分别用过量红磷、白磷、蜡烛进行该实验,用测氧气浓度的传感器测得反应后的氧气浓度分别为8.85%、3.21%、16.7%,数据与表中的理论值基本一致。其中蜡烛燃烧后用测一氧化碳浓度传感器测算一氧化碳浓度约为2%。
资料2:二氧化碳因与氢氧化钠溶液发生化学反应,实验室常用氢氧化钠溶液来吸收二氧化碳。
资料3:蜡烛或者木炭在密闭的集气瓶中燃烧,氧气浓度不断变小的同时,会有一氧化碳气体生成。常温下一氧化碳难溶于水,且不与氢氧化钠溶液反应。
(交流与讨论)根据以上信息回答下列问题:
①白磷和红磷相比,使用白磷能使结果更准确,其原因是__________。
②有同学提议选用木炭替代红磷做实验,在集气瓶底部预先放少量氢氧化钠溶液吸收生成的二氧化碳气体,小华觉得不可行,其主要原因是___________。
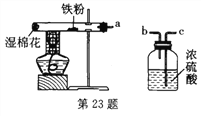
(实验改进2)食品脱氧剂(以铁粉为主的物质组成)能通过化学反应除去密闭包装袋中的氧气,使食品处于无氧状态。同学们尝试用图4装置进行实验来测定空气中氧气的含量。
下表是实验过程中记录的有关数据:
实验所需的时间/min | 0 | 5 | 10 | 30 | 35 | 45 |
量筒中液面的刻度/mL | 50 | 35 | 27.5 | 19.7 | 19.7 | 19.7 |
①脱氧剂发生复杂的化学反应,首先是铁粉与氧气、水反应生成氢氧化亚铁固体,写出该反应的符号表达式________。
②分析表中数据得知,至少经过________分钟后,量筒中的液面不再下降。
③根据表中实验数据进行推算,广口瓶中氧气的体积分数约为__________(结果精确到0.1%)
(实验拓展)铁在不同的条件下与氧气反应可生成不同种铁的氧化物, 58g四氧化三铁与多少克氧化铁(Fe2O3)中所含铁元素质量相等?_______(写出计算过程)
p>(实验评价)与燃烧红磷法相比,用脱氧剂测定空气中氧气含量的优点是__________。