题目内容
【题目】某化学探究小组用盐酸与大理石的反应来研究影响反应速率的因素。实验温度为![]() 、
、![]() ;大理石有细颗粒与粗颗粒两种规格,每次实验取用含碳酸钙
;大理石有细颗粒与粗颗粒两种规格,每次实验取用含碳酸钙![]() 的大理石10g;所用盐酸的质量分数为
的大理石10g;所用盐酸的质量分数为![]() 、
、![]() ,每次实验盐酸的用量为
,每次实验盐酸的用量为![]() 假设
假设![]() 、
、![]() 的盐酸的密度均为
的盐酸的密度均为![]() ;大理石中杂质不与盐酸反应
;大理石中杂质不与盐酸反应![]() 。
。
(提岀假设)盐酸与大理石反应的反应速率与所用盐酸的质量分数、大理石规格、反应温度有关。
![]() (实验设计与实施)完成以下实验设计方案并实验
(实验设计与实施)完成以下实验设计方案并实验
实验 编号 |
| 大理石 规格 | 盐酸的 质量分数 | 完全反应 的时间 | 实验目的 |
| 25 | 粗颗粒 |
| 160 |
|
| ______ | ______ | ______ | 210 | |
| 35 | 粗颗粒 |
| 60 | |
| ______ | ______ | ______ | 100 |
![]() 从实验
从实验![]() 和
和![]() 可以得出的实验结论是:______。
可以得出的实验结论是:______。
![]() 含碳酸钙
含碳酸钙![]() 的大理石中,含有碳酸钙的质量为______g。
的大理石中,含有碳酸钙的质量为______g。
![]() 碳酸钙与盐酸反应的化学方程式为______;若
碳酸钙与盐酸反应的化学方程式为______;若![]() 中的大理石与过量稀盐酸充分反应,能生成二氧化碳的质量为______
中的大理石与过量稀盐酸充分反应,能生成二氧化碳的质量为______![]() 只列计算式,已知碳酸钙的相对分子质量为100,二氧化碳的相对分子质量为
只列计算式,已知碳酸钙的相对分子质量为100,二氧化碳的相对分子质量为![]() 。
。
【答案】25 粗颗粒 ![]() 25 细颗粒
25 细颗粒 ![]() 在其他条件不变时,温度越高,反应越剧烈 6
在其他条件不变时,温度越高,反应越剧烈 6 ![]()
![]()
【解析】
(1)联系物理中学过的控制变量法,根据实验a和b探究同体积下HCl质量分数对该反应剧烈程度的影响,就可以得出其温度和大理石规格应该是控制相同的;所以,实验b中的空缺应该分别是25、粗颗粒和9.125%;同理,实验d中的空缺应该分别是25、细颗粒和18.25%;
(2)根据实验①和②探究时间(即160s和210s)可知,实验①比②用时少;这就说明了实验①比②反应剧烈;也就不难得出:在其他条件不变时,盐酸质量分数越大,反应越剧烈。同理可得,在其他条件不变时,温度越高,反应越剧烈;固体的颗粒越小,反应越剧烈;所以,该实验结论应该是:在其他条件不变时,盐酸质量分数越大,反应越剧烈;温度越高,反应越剧烈;固体的颗粒越小,反应越剧烈;
(3)10g含碳酸钙60%的大理石中,含有碳酸钙的质量为:10g×60%=6g;
(4)碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;
设生成二氧化碳的质量为x,则:
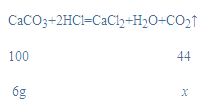
![]()
x=2.64g。

【题目】我省两淮地区煤炭资源丰富,瓦斯存在于煤层及周围岩层中,是井下有害气体的总称,主要成分是甲烷.
(1)请你写出甲烷完全燃烧的化学方程式:______.
(2)煤矿瓦斯爆炸有两个必要条件:①瓦斯含量在爆炸极限的范围内;②______.
(3)下表是常见三种气体的爆炸极限,请你据此判断:
可燃气体 | 爆炸极限(体积分数) |
H2 | 4.0%~74.2% |
CH4 | 5%~15% |
CO | 12.5%~74.2% |
最容易发生爆炸的气体是______.
(4)下列图标中,与燃烧和爆炸无关的是______.

(5)某现代化的矿井采用了“低浓度瓦斯发电技术”,有效解决了矿区及周边地区的照明用电.这种既采煤又发电联合生产的优点是______.
【题目】通过下列实验操作和现象能得出相应结论的是![]()
![]()
实验操作 | |||
A | 想收集满CO2的软塑料瓶中加入约1/3体积的水,旋紧瓶盖,振荡 | 塑料瓶变瘪 | CO2能与水反应 |
B | 把燃着的木条插入某瓶无色气体中 | 木条熄灭 | 该瓶中气体可能是二氧化碳 |
C | 把MnO2加入过氧化氢溶液中 | 快速产生气泡 | MnO2能增加O2的产量 |
D | 称量铜粉在空气中加热前后的质量 | 加热后的质量比原来铜粉的质量大 | 该化学反应不遵守质量守恒定律 |
A. AB. BC. CD. D