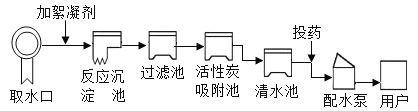
题目内容
【题目】已知标准状况下,氮气的密度为1.25g/L。氮化硅(化学式为Si3N4)是一种新型陶瓷材料,可用气相沉积法制得,反应原理为:SiCl4+2N2+6H3=Si3N4+12HCl.现需要制取28g氮化硅,求:
(1)请根据化学方程式计算需要消耗氮气的质量_____。
(2)若这些氮气全部来自空气,则需要消耗空气的体积约为______L(精确到0.LL)。
【答案】11.2g 11.2
【解析】
根据氮化硅的质量和对应的化学方程式求算消耗的氮气的质量,进而求算对应的空气的体积。
解:设消耗的氮气的质量为x,
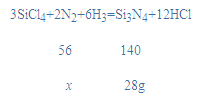
![]()
x=11.2g,
对应空气的体积为![]() ÷
÷![]() =11.2L;
=11.2L;
答:(1)需要消耗氮气的质量为11.2g;
(2)若这些氮气全部来自空气,则需要消耗空气的体积约为 11.2L。

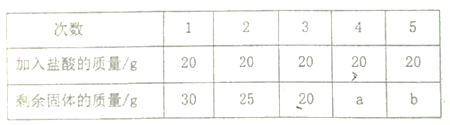
【题目】某化学探究小组用盐酸与大理石的反应来研究影响反应速率的因素。实验温度为![]() 、
、![]() ;大理石有细颗粒与粗颗粒两种规格,每次实验取用含碳酸钙
;大理石有细颗粒与粗颗粒两种规格,每次实验取用含碳酸钙![]() 的大理石10g;所用盐酸的质量分数为
的大理石10g;所用盐酸的质量分数为![]() 、
、![]() ,每次实验盐酸的用量为
,每次实验盐酸的用量为![]() 假设
假设![]() 、
、![]() 的盐酸的密度均为
的盐酸的密度均为![]() ;大理石中杂质不与盐酸反应
;大理石中杂质不与盐酸反应![]() 。
。
(提岀假设)盐酸与大理石反应的反应速率与所用盐酸的质量分数、大理石规格、反应温度有关。
![]() (实验设计与实施)完成以下实验设计方案并实验
(实验设计与实施)完成以下实验设计方案并实验
实验 编号 |
| 大理石 规格 | 盐酸的 质量分数 | 完全反应 的时间 | 实验目的 |
| 25 | 粗颗粒 |
| 160 |
|
| ______ | ______ | ______ | 210 | |
| 35 | 粗颗粒 |
| 60 | |
| ______ | ______ | ______ | 100 |
![]() 从实验
从实验![]() 和
和![]() 可以得出的实验结论是:______。
可以得出的实验结论是:______。
![]() 含碳酸钙
含碳酸钙![]() 的大理石中,含有碳酸钙的质量为______g。
的大理石中,含有碳酸钙的质量为______g。
![]() 碳酸钙与盐酸反应的化学方程式为______;若
碳酸钙与盐酸反应的化学方程式为______;若![]() 中的大理石与过量稀盐酸充分反应,能生成二氧化碳的质量为______
中的大理石与过量稀盐酸充分反应,能生成二氧化碳的质量为______![]() 只列计算式,已知碳酸钙的相对分子质量为100,二氧化碳的相对分子质量为
只列计算式,已知碳酸钙的相对分子质量为100,二氧化碳的相对分子质量为![]() 。
。