题目内容
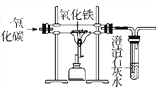
【题目】用下图所示的装置进行实验,研究物质的化学性质。

(1)若向点滴板孔穴1、2中分别加入碳酸纳,该实验的目的是___________。
(2)若要证明Zn的金属活动性比Cu强,应进行的操作的___________。
(3)若向孔穴2中加石蕊试剂和Zn粒,观察到产生气体,溶液由红变紫,用化学方程式解释原因:____。
【答案】 研究稀盐酸、稀硫酸是否都能与碳酸钠反应 将锌粒/片放入3中(或其它合理答案) Zn + H2SO4=ZnSO4 + H2↑
【解析】(1)若向点滴板孔穴1、2中分别加入碳酸纳,该实验的目的是探究稀盐酸、稀硫酸是否都能与碳酸钠反应。(2)金属活动性顺序中,排在前面的金属能把排在后面的金属从其化合物的水溶液中置换出来。(3)锌与稀硫酸反应生成氢气,生成的硫酸锌溶液显中性,不能使紫色石蕊溶液变色。

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案【题目】同学们尝试获取含有色素的“紫甘蓝提取液”,并探究该提取液能否作为酸碱指示剂。
将撕碎的紫甘蓝叶片用纯净水浸泡,过滤后即可得到蓝色的提取液。
实验1-探究紫甘蓝提取液颜色随溶液pH的变化。
用盐酸、NaOH、水配制一定pH的溶液,分别向其中加入10滴紫甘蓝提取液,溶液的颜色如下。
溶液pH | 2 | 4 | 7 | 10 | 12 |
溶液颜色 | 红 | 红 | 蓝 | 绿 | 绿 |
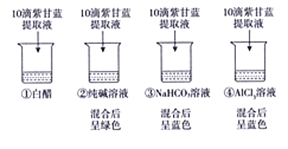
实验2-用紫甘蓝提取液检测常见溶液的酸碱性。
【解释与结论】
(1)紫甘蓝中的色素____(填“能”或“不能”)溶于水。
(2)依据实验现象判断,Na2C03溶液呈____(填“酸性”“中性”或“碱性”)。
(3)若白醋的pH为3,则白醋中滴加紫甘蓝提取液后,混合溶液的颜色为 ___。
(4)根据目前的实验现象,不能断定NaHC03溶液呈中性,理由是____________。
【反思与评价】
(5)同学们查阅资料知AlCl3溶液的pH通常在3—4之间,由此判断实验2中,溶液④呈蓝色不是溶液酸碱性导致的,理由是____________________。
(6)同学们认为紫甘蓝提取液不是良好的酸碱指示剂,原因是____。