题目内容
 (2011?仪征市一模)长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO2)固体,为鱼提供氧气,过氧化钙与水反应除生成氧气外,还生成什么物质?课外兴趣小组决定对这一过程中进行探究:
(2011?仪征市一模)长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO2)固体,为鱼提供氧气,过氧化钙与水反应除生成氧气外,还生成什么物质?课外兴趣小组决定对这一过程中进行探究:实验探究一:过氧化钙与水反应除生成氧气外,还生成什么物质?
【猜想】另一生成物为氢氧化钙.
【进行实验】
取适量过氧化钙放入试管中加适量水,向试管中滴加酚酞试液,液体变成
红色
红色
色,则猜想成立.写出反应的化学方程式2CaO2+2H2O=2Ca(OH)2+O2↑
2CaO2+2H2O=2Ca(OH)2+O2↑
.【意外发现】
较长时间后,同学们发现滴入酚酞后变色了的液体颜色又变回无色,他们认为褪色的可能原因是
二氧化碳与氢氧化钙反应,没有氢氧化钙了
二氧化碳与氢氧化钙反应,没有氢氧化钙了
.【查阅资料】
过氧化钙放置在空气中,会变质产生氢氧化钙和碳酸钙两种杂质.
实验探究二:测定久置过氧化钙纯度
【实验过程】
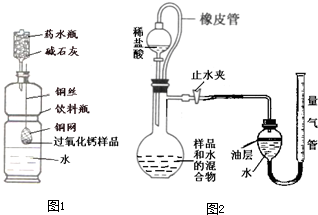
称量144g样品放在铜网中,按图1所示装置组装后(药水瓶底部留有小孔),称量仪器及药品总质量,将铜网插入足量水中,反应完全后称量仪器
及反应后物质总质量.测得实验数据如下表.
| 样品质量 | 装置及药品总质量 | 装置及反应后物质总质量 | |
| 实验数据 | 144g | 394g | 378g |
(1)药水瓶中碱石灰的作用为
吸收生成氧气中的水蒸气
吸收生成氧气中的水蒸气
.(2)本实验测得过氧化钙含量可能会偏小的原因是
碱石灰吸收空气中二氧化碳与水
碱石灰吸收空气中二氧化碳与水
.(3)根据实验数据计算:①生成氧气
16g
16g
g.②样品中过氧化钙的含量是50%
50%
.实验探究三:测定久置过氧化钙样品中碳酸钙含量
【测定方案】
①如图2所示,连接好装置,检查装置气密性;
②精确称量一袋样品质量置于烧杯中并加入适量水混合,再全部倒入烧瓶中,并在分液漏斗中加入足量稀盐酸;
③将液面调节到量气管的“0”刻度,并使两边液面相平,打开止水夹和分液漏斗活塞;
④反应结束后,再次调节量气管两边液面相平,读出气体体积;
⑤计算样品中碳酸钙含量(CO2的密度为1.97g/L).
【问题讨论】
(4)图中油层的作用为
隔绝二氧化碳和水的接触
隔绝二氧化碳和水的接触
,油层上方留有空气,会使测量结果无影响
无影响
(填“偏大”、“偏小”或“无影响”).中和反应放热,滴加稀盐酸后,发生装置中的中和反应的化学方程式为Ca(OH)2+2HCl=CaCl2+2H2O
Ca(OH)2+2HCl=CaCl2+2H2O
.(5)若测得量气管读数为896mL,则实验中选用的量气管规格合适的是
B
B
(填字母序号) A、100ml B、1L C、2L
(6)测定方案的步骤4中再次调节量气管两边液面相平的方法为
固定左边仪器,将右边量气管向下移
固定左边仪器,将右边量气管向下移
.步骤2中将样品和水混合的目的是使样品中过氧化钙转化为氢氧化钙,否则有氧气生成影响实验结果
使样品中过氧化钙转化为氢氧化钙,否则有氧气生成影响实验结果
.(7)在充分反应后将烧瓶中的液体蒸干得到55.5g固体,求这袋样品在变质前的过氧化钙质量(写计算过程).
分析:实验探究一:根据实验探究的过程和学过的知识可知:酚酞试液遇到碱性溶液变成红色;过氧化钙与水反应生成氢氧化钙和氢气;较长时间后,同学们发现滴入酚酞后变色了的液体颜色又变回无色,是因为Ca(OH)2被空气中的二氧化碳反应掉了;
实验探究二:药水瓶中碱石灰的作用为吸收O2中的水蒸气,起干燥作用;本实验测得过氧化钙含量可能会偏小的原因是:生成的氧气排走了空气,造成瓶内气体质量增大;有关的计算要准确.
实验探究三:油层的作用为:隔绝水和CO2,防止CO2溶于水;油层上方留有空气,不会影响测量结果;氢氧化钙和盐酸反应生成氯化钙和水,此过程是放热反应,造成气体体积膨胀,因此结果偏大.调节量气管内液面与油层液面相平的方法是:要上下移动量气管,至量气管内的液面与油层液面相平;除去CaO2,防止在烧瓶中产生氧气;有关的计算要准确.根据得到27.75g固体,可以求钙元素的质量,求碳酸钙的质量,最后求过氧化钙的质量.
实验探究二:药水瓶中碱石灰的作用为吸收O2中的水蒸气,起干燥作用;本实验测得过氧化钙含量可能会偏小的原因是:生成的氧气排走了空气,造成瓶内气体质量增大;有关的计算要准确.
实验探究三:油层的作用为:隔绝水和CO2,防止CO2溶于水;油层上方留有空气,不会影响测量结果;氢氧化钙和盐酸反应生成氯化钙和水,此过程是放热反应,造成气体体积膨胀,因此结果偏大.调节量气管内液面与油层液面相平的方法是:要上下移动量气管,至量气管内的液面与油层液面相平;除去CaO2,防止在烧瓶中产生氧气;有关的计算要准确.根据得到27.75g固体,可以求钙元素的质量,求碳酸钙的质量,最后求过氧化钙的质量.
解答:解:【进行实验】酚酞试液遇到碱性溶液变成红色;过氧化钙与水反应生成氢氧化钙和氢气;故答案为:红 2CaO2+2H2O=2Ca(OH)2+O2↑
【意外发现】较长时间后,同学们发现滴入酚酞后变色了的液体颜色又变回无色,是因为Ca(OH)2被空气中的二氧化碳反应掉了;故答案为:Ca(OH)2与空气中的二氧化碳气体反应成生了碳酸钙
(1)药水瓶中碱石灰的作用为吸收O2中的水蒸气,起干燥作用;故答案为:吸收O2中的水蒸气
(2)本实验测得过氧化钙含量可能会偏小的原因是:生成的氧气排走了空气,造成瓶内气体质量增大;故答案为:生成的氧气排走了空气,造成瓶内气体质量增大(其它合理答案也可)
(3)根据质量守恒定律:生成氧气的质量=394.0g-378.0g=16.0g;
设过氧化钙的质量分数为x
2CaO2+2H2O=2Ca(OH)2+O2↑
144 32
144.0g?x 16g
=
x=50%
故答案为:①16.0g;②50%
问题讨论:
(4)二氧化碳会与水反应,对测定的体积产生影响,生成多少二氧化碳就会排出多少水,油层的作用为:隔绝水和CO2,防止CO2溶于水;油层上方的空气对测定的结果不会产生影响,但是盐酸和氢氧化钙中和生成氯化钙和水,反应的化学方程式为Ca(OH)2+2HCl=CaCl2+2H2O
(5)选用量气管要接近所测得体积,太大或太小都会产生误差,
(6)调节量气管内液面与油层液面相平的方法是:要上下移动量气管,至量气管内的液面与油层液面相平;
通过改变液面的高度,改变产生的压强差,如果在集气瓶中,过氧化钙会与水反应生成的氧气,是测定的结果偏大.
(7)根据得到55.5g固体为氯化钙,可以求钙元素的质量,最后求过氧化钙的质量.
故答案为:探究一:红色 2CaO2+2H2O=2Ca(OH)2+O2↑
二氧化碳与氢氧化钙反应,没有氢氧化钙了
探究二:(1)吸收生成氧气中的水蒸气 (2)、碱石灰吸收空气中二氧化碳与水
(3)16g 50% 探究三:
(4)隔绝二氧化碳和水的接触 无影响
Ca(OH)2+2HCl=CaCl2+2H2O
(5)B
(6)固定左边仪器,将右边量气管向下移 使样品中过氧化钙转化为氢氧化钙,否则有氧气生成影响实验结果
( 7)解法一
设原来纯过氧化钙质量为x
CaO2~CaCl2
72 111
X 55.5g
X=36g
解法二
先算出氯化钙中钙元素,因为反应前后钙元素守恒,可根据钙元素求出纯过氧化钙质量
【意外发现】较长时间后,同学们发现滴入酚酞后变色了的液体颜色又变回无色,是因为Ca(OH)2被空气中的二氧化碳反应掉了;故答案为:Ca(OH)2与空气中的二氧化碳气体反应成生了碳酸钙
(1)药水瓶中碱石灰的作用为吸收O2中的水蒸气,起干燥作用;故答案为:吸收O2中的水蒸气
(2)本实验测得过氧化钙含量可能会偏小的原因是:生成的氧气排走了空气,造成瓶内气体质量增大;故答案为:生成的氧气排走了空气,造成瓶内气体质量增大(其它合理答案也可)
(3)根据质量守恒定律:生成氧气的质量=394.0g-378.0g=16.0g;
设过氧化钙的质量分数为x
2CaO2+2H2O=2Ca(OH)2+O2↑
144 32
144.0g?x 16g
| 144 |
| 144.0g?x |
| 32 |
| 16g |
x=50%
故答案为:①16.0g;②50%
问题讨论:
(4)二氧化碳会与水反应,对测定的体积产生影响,生成多少二氧化碳就会排出多少水,油层的作用为:隔绝水和CO2,防止CO2溶于水;油层上方的空气对测定的结果不会产生影响,但是盐酸和氢氧化钙中和生成氯化钙和水,反应的化学方程式为Ca(OH)2+2HCl=CaCl2+2H2O
(5)选用量气管要接近所测得体积,太大或太小都会产生误差,
(6)调节量气管内液面与油层液面相平的方法是:要上下移动量气管,至量气管内的液面与油层液面相平;
通过改变液面的高度,改变产生的压强差,如果在集气瓶中,过氧化钙会与水反应生成的氧气,是测定的结果偏大.
(7)根据得到55.5g固体为氯化钙,可以求钙元素的质量,最后求过氧化钙的质量.
故答案为:探究一:红色 2CaO2+2H2O=2Ca(OH)2+O2↑
二氧化碳与氢氧化钙反应,没有氢氧化钙了
探究二:(1)吸收生成氧气中的水蒸气 (2)、碱石灰吸收空气中二氧化碳与水
(3)16g 50% 探究三:
(4)隔绝二氧化碳和水的接触 无影响
Ca(OH)2+2HCl=CaCl2+2H2O
(5)B
(6)固定左边仪器,将右边量气管向下移 使样品中过氧化钙转化为氢氧化钙,否则有氧气生成影响实验结果
( 7)解法一
设原来纯过氧化钙质量为x
CaO2~CaCl2
72 111
X 55.5g
X=36g
解法二
先算出氯化钙中钙元素,因为反应前后钙元素守恒,可根据钙元素求出纯过氧化钙质量
点评:有关实验方案的设计和对实验方案的评价是中考的热点之一,设计实验方案时,要注意用最少的药品和最简单的方法;关于对实验设计方案的评价,要在两个方面考虑,一是方案是否可行,能否达到实验目的;二是设计的方法进行比较,那种方法更简便.

练习册系列答案
相关题目
 (2011?仪征市一模)在宏观、微观和符号之间建立联系是化学学科的特点.
(2011?仪征市一模)在宏观、微观和符号之间建立联系是化学学科的特点. (2011?仪征市一模)一碳化学是以分子中只含一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学.工业上常用天然气和水蒸气或二氧化碳经高温催化反应得到CO和H2,得到的CO和H2的混合气被称为合成气.如图为利用合成气合成新型燃料二甲醚(CH3OCH3)及冶炼铁的部分生产过程.
(2011?仪征市一模)一碳化学是以分子中只含一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学.工业上常用天然气和水蒸气或二氧化碳经高温催化反应得到CO和H2,得到的CO和H2的混合气被称为合成气.如图为利用合成气合成新型燃料二甲醚(CH3OCH3)及冶炼铁的部分生产过程.