题目内容
【题目】(1)请你与小明和他的同学一起进行实验室制取二氧化碳的探究.
小明对三组药品进行了研究,实验记录如下:
组别 | 药品 | 实验现象 |
① | 块状石灰石和稀盐酸 | 产生气泡速率适中 |
② | 块状石灰石和稀硫酸 | 产生气泡速率缓慢并逐渐停止 |
③ | 碳酸钠粉末和稀盐酸 | 产生气泡速率很快 |
从制取和收集的角度分析,一般选择第①组药品,所发生反应的化学方程式为_____;不选择第③组药品的原因是_____.
(2)老师为他们提供的如图1所示的实验仪器(导管、橡皮塞等未画出).
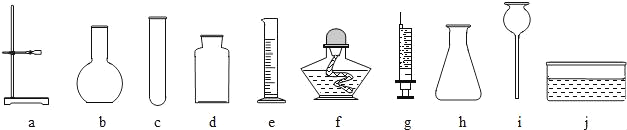
小明根据提供的实验仪器分别设计了如图2所示四套制取和收集二氧化碳的装置.
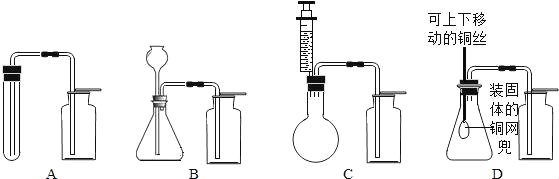
对上面的设计方案小明和他的同学进行了交流讨论.
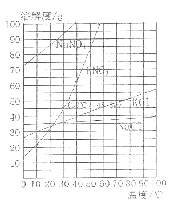
其中可能收集不到二氧化碳气体的装置是_____;能够使反应随时停止和发生的装置是_____.用澄清石灰水可鉴定CO2 气体,请写出其化学方程式为_____.
反思小结:
气体制取和收集装置的选择依据:①发生装置——反应物状态和反应条件;②收集装置——气体密度、气体溶解性和_____.
【答案】CaCO3+2HCl=CaCl2+H2O+CO2↑ 反应太快 A D CO2+Ca(OH)2=CaCO3↓+H2O 气体是否与水反应
【解析】
(1)二氧化碳的制取药品很多,从实验现象中可以看出:三种药品都产生二氧化碳,但是块状石灰石和稀硫酸反应一会儿停止,碳酸钠粉末与稀盐酸反应速度太快,无法收集;因此,选择块状石灰石和稀盐酸来制取二氧化碳.反应原理为CaCO3+2HCl=CaCl2+H2O+CO2↑.
(2)装置A中发生装置部分,玻璃导管几乎伸到试管底部,加入一定稀盐酸后,导管口可能被液封,产生的二氧化碳气体不能排出,故使用A有可能收集不到二氧化碳气体;要达到“随时发生随时停止”反应的目的,需要解决固体和液体随时接触或分离,由于D装置中盛放碳酸钙的铜网可上下移动,满足随时接触随时分离的要求.故选D
[反思小结]根据二氧化碳不采取排水法收集,可发现,能溶于水或能与水发生反应的气体都不适合使用排水法收集.
故答案为:(1)CaCO3+2HCl=CaCl2+H2O+CO2↑;反应太快;
(2)A;D;CO2+Ca(OH)2=CaCO3↓+H2O;
[反思小结]气体是否与水反应.

 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案【题目】(1)元素周期表是化学学习和研究的重要工具。下图是元素周期表的一部分。
1H 1.008 | 2He 4.003 | ||||||
3Li 6.941 | 4Be 9.012 | 5B 10.81 | 6C 12.01 | 7N 14.01 | 8O 16.00 | 9F 19.00 | 10Ne 20.18 |
11Na 22.99 | 12Mg 24.31 | 13Al 26.98 | 14Si 28.09 | 15P 30.97 | 16S 32.06 | 17Cl 35.45 | 18Ar 39.95 |
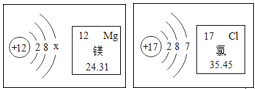
①表中查出硅(Si)元素的相对原子质量为_____;
②9号元素与12号元素形成化合物的化学式为_____;
③11号元素至18号元素同属第三周期,从核外电子排布来看你发现的规律是_____。
(2)在化学反应中,反应物中某元素的化合价在反应后如果增加,则该物质是还原剂,如果是减少的则该物质是氧化剂。请判断反应:2Na+Cl2![]() 2NaCl中,还原剂是_____。
2NaCl中,还原剂是_____。