题目内容
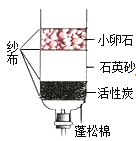
【题目】现欲探究一固体混合物A的成分,已知其中可能含有Na2CO3、NaCl、Ba(NO3)2、Cu(NO3)2四种物质中的两种或多种。按下图所示进行实验,出现的现象如图中所述(设过程中所有可能发生的反应都恰好完全进行)。
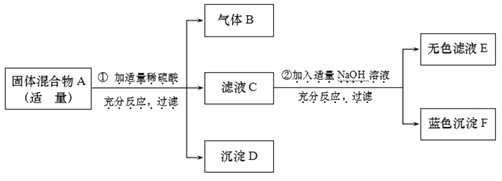
试根据实验过程和发生反应的现象做出判断,填写以下空白:
(1)气体B的化学式为________。
(2)沉淀D的化学式为_______。
(3)写出实验过程②中生成蓝色沉淀F的一个化学方程式________。
(4)滤液C中肯定大量存在的金属离子符号为_______。
(5)混合物A中,还不能确定存在的物质的化学式为_______。
【答案】CO2 BaSO4 Cu(NO3)2+2NaOH = Cu(OH)2↓ + 2NaNO3 Na+、Cu2+ NaCl
【解析】
稀硫酸能够和碳酸钠反应产生二氧化碳气体;利用滤液C能够和氢氧化钠反应产生蓝色沉淀G,因此说明C中含有铜离子;钡离子与硫酸根离子反应产生的硫酸钡沉淀;本题的解题突破口是固体混合物与硫酸混合生成使澄清石灰水变浑浊的气体,说明含碳酸钠;滤液与氢氧化钠反应生成了蓝色沉淀,说明含有硝酸铜;沉淀D为硫酸钡,据此分析完成相关的问题。
固体混合物与硫酸混合生成使澄清石灰水变浑浊的气体,说明含碳酸钠;滤液与氢氧化钠反应生成了蓝色沉淀,说明含有硝酸铜;沉淀D是硫酸钡,则一定含有硝酸钡;因此:
(1)由以上推断可知,气体B是二氧化碳,可表示为:CO2;
(2)由以上推断可知,沉淀D是硫酸钡;可表示为:BaSO4;
(3)硝酸铜与氢氧化钠反应生成氢氧化铜蓝色沉淀和硝酸钠;化学方程式为:Cu(NO3)2+2NaOH═Cu(OH)2↓+2NaNO3;
(4)滤液C中一定含有硝酸铜和硫酸钠,其中含有的金属离子是钠离子与铜离子;可表示为:Na+、Cu2+;
(5)由以上实验无法确定原固体中是否含有氯化钠;可表示为:NaCl。

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】“五一”假期,小兵对“锌与硫酸反应快慢的影响因素”进行了探究。
【提出问题】锌与硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】a.可能与硫酸的质量分数有关;b.可能与锌的形状有关。
【设计并实验】小兵用不同质量分数的硫酸和不同形状的锌进行如下实验。
实验编号 | 硫酸的质量分数 (均取20mL) | 锌的形状 (均取1g) | 氢气的体积(mL) (均收集3分钟) |
① | 20% | 锌粒 | 31.7 |
② | 20% | 锌片 | 50.9 |
③ | 30% | 锌粒 | 61.7 |
④ | 30% | 锌片 | 79.9 |
(1)写出稀硫酸与锌反应的化学方程式________________________________________。
(2)小兵用下图装置收集并测量氢气的体积,其中量筒的作用是_______________________,氢气应从________(填e或f或g)管通入。

【收集证据】
(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是____________。
【得出结论】
(4)结论是___________________________________________。
【评价与反思】(注意:若答对(5)(6)两小题奖励4分,化学试卷总分不超过60分)
(5)下表是小兵第①组实验的详细数据。
时段(均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
H2的体积 | 3.1mL | 16.7mL | 11.9mL | 9.6mL | 7.6mL | 6.0mL |
请描述锌与硫酸反应的快慢的变化并解释原因______________________________。
(6)锌与硫酸反应的快慢可能还受哪些因素影响?设计实验验证。
_____________________________________。
【题目】安多夫是一种嫩肉粉,其主要成分碳酸氢钠(NaHCO3)和氯化钠。安多夫可促进肉类吸收水分,从而使肉质松软,达到鲜嫩爽滑的目的。小张发现将拌了安多夫粉的肉类放到锅中加入食醋等调料烧煮时会产生大量的气体,他对此颇感兴趣,决定对其进行探究。
(查阅资料)
碳酸氢钠俗称“小苏打”、“重曹”,白色细小晶体,加热到50℃以上开始逐渐分解生成碳酸钠、二氧化碳和水,440℃时完全分解。
白色无水硫酸铜遇到水会变成蓝色。
(实验探究一)对烧煮时产生大量气体的成分和来源进行探究
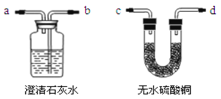
小于对气体的成分进行了猜测:气体中除了醋酸气体之外,还可能含有水蒸气和CO2。他设法收集气体样品并除去醋酸气体后,用右图实验装置进行验证。装置导气口连接顺序:气体样品 →____→____→____→ ___ 。
小于对二氧化碳的来源作了两种猜测:
猜测①:二氧化碳可能是由碳酸氢钠与______________发生化学反应产生的;
猜测②:二氧化碳可能是由碳酸氢钠受热分解产生的,反应方程式为________________。
针对以上猜测,小于设计了以下实验:
实验步骤 | 实验现象 | |
实验1 | ___________________________________________________________________。 | ________________________________________________________________。 |
实验2 | 取安多夫样品少许加入试管中,加热使之充分反应,并把产生的气体通入澄清石灰水。 | 试管口出现小水珠,澄清石灰水变浑浊,试管中残留白色固体粉末。 |
实验结论:猜想①、②都正确
(实验探究二)测定安多夫样品中碳酸氢钠的含量
实验2中,小于发现充分反应后,试管中仍留有一些白色固体粉末,通过查阅资料发现是碳酸钠和氯化钠。小于想用测定白色固体中碳酸钠的质量来推算安多夫样品中碳酸氢钠的含量,于是称取实验2中得到的白色固体粉末6.9克,设计了如下实验方案:
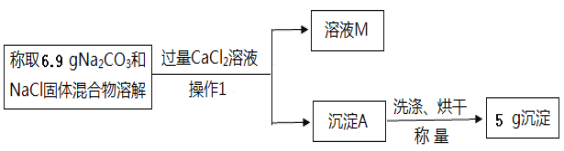
(1)操作1的名称是___________,沉淀A的化学式是___________,实验中加入过量CaCl2溶液的目的是___________________________。
(2)求6.9克白色固体中碳酸钠的质量是多少?________(写出解题过程)
(3)上述实验方案中,若沉淀A缺少“洗涤”操作,则会使测得样品中NaHCO3的质量分数_________(填“偏大”、“偏小”或“不变”)
【题目】化学小组围绕“铁丝在氧气中燃烧现象及产物”的问题,进行了相应的探究活动。
活动1:“火星四射”的现象与铁丝含碳量的关系
实验操作 | 实验现象 | 实验结论 |
实验1:取直径0.20mm,含碳0.1%的铁丝,在氧气中燃烧 | 零星火星 | 铁丝燃烧的符号表达式是___________________ “火星四射”与铁丝含碳量的关系是_____________。 |
实验2:取直径_____mm,含碳0.3%的铁丝,在氧气中燃烧 | 较明显的火星四射 |
活动2:黑色固体中是否含有铁?
资料:①铁粉和四氧化三铁为黑色固体,均具有磁性,可用磁铁吸引。
②铁、四氧化三铁均能溶于稀盐酸(即:铁 + 盐酸 →氯化亚铁 + 氢气;四氧化三铁+盐酸→氯化铁+氯化亚铁+水)
③氯化亚铁溶液为浅绿色,氯化铁溶液为黄色。
小明质疑小刚用磁铁来检验黑色固体是否含有铁的方案,其理由是________;同学们都认可了下列实验方案:
实验操作 | 实验现象 | 实验结论 |
取少量黑色固体于试管中,加入一定量__________,放置一段时间 | 有气泡产生,溶液由无色变为黄色 | 黑色固体中含有铁 |