题目内容
某兴趣小组同学对实验室制取氧气的条件进行如下探究实验.(1)已知2KClO3
 2KCl+3O2↑,CuO也可作氯酸钾分解的催化剂.甲同学为探究催化剂的种类对氯酸钾分解速率的影响,设计了以下对比试验:
2KCl+3O2↑,CuO也可作氯酸钾分解的催化剂.甲同学为探究催化剂的种类对氯酸钾分解速率的影响,设计了以下对比试验:I.将xgKClO3与1.0gMnO2均匀混合加热 II.将3.0gKClO3与1.0gCuO均匀混合加热
在相同温度下,比较两组实验产生O2的快慢.
①I中x的值为 ;②II中的CuO与稀盐酸反应的方程式为 .
(2)乙同学探究了影响双氧水分解速度的某种因素,实验数据记录如表:
| 双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生O2的体积 | |
| I | 50.0g | 1% | 0.1g | 9mL |
| II | 50.0g | 2% | 0.1g | 16mL |
| III | 50.0g | 4% | 0.1g | 31mL |
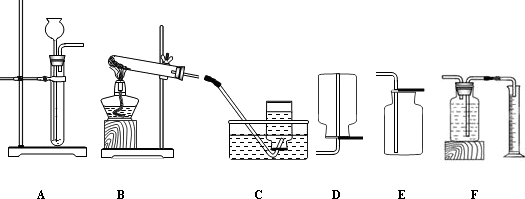
①本实验中,测量O2体积的装置是 (填编号).

②实验结论:在相同条件下, ,双氧水分解得快.
③丙用如图2装置进行实验,通过比较 也能达到实验目的.
(3)用氯酸钾和二氧化锰的混合物制取O2,完全反应后的固体残渣,经以下四步实验操作,可回收得到较纯净的二氧化锰(残渣中只有二氧化锰难于水).正确操作的先后顺序是 (填写选项符号).
a.烘干 b.溶解 c.过滤 d.洗涤
(4)某同学根据所学知识设计了一个自动加液过滤装置:在普通过滤装置的漏斗上安装一个自动加液装置(图3).使用时,滤液不会溢出,过滤又较快,整个过程无须人照顾.自动加液装置中A管为“液体流出管”,B管为“空气导入管”. A管上口高出B管口约1cm.试回答问题:A管上口高出B管上口的理由是 .
【答案】分析:控制变量法只能控制一个变量,因此X是3.0;氧化铜与盐酸反应生成氯化铜和水;本实验中,测量O2体积的装置是C,因为氧气密度比水的密度小,必须从短管进入,才能把水排出来;由表格信息可知:在相同条件下,双氧水浓度越大,双氧水分解得快;用如图2装置进行实验,通过比较相同时间天平读数差值大小也能达到实验目的;用氯酸钾和二氧化锰的混合物制取O2,完全反应后的固体残渣是氯化钾和二氧化锰,氯化钾溶于水,二氧化锰不溶于水,因此可以通过溶解、过滤、洗涤、干燥的方法,回收得到较纯净的二氧化锰;A管上口高出B管上口的理由是:便于达到“自动过滤”的目的;若A管上口低于B管上口或与B管上口平齐都不能实现“自动过滤”的目的.
解答:解:(1)控制变量法只能控制一个变量,因此X是3.0;氧化铜与盐酸反应生成氯化铜和水;故答案为:①3.0 ②CuO+2HCl=CuCl2+H2O
(2)本实验中,测量O2体积的装置是C,因为氧气密度比水的密度小,必须从短管进入,才能把水排出来;由表格信息可知:在相同条件下,双氧水浓度越大,双氧水分解得快;用如图2装置进行实验,通过比较相同时间天平读数差值大小也能达到实验目的;故答案为:①C;②双氧水浓度越大; ③相同时间天平读数差值大小.
(3)用氯酸钾和二氧化锰的混合物制取O2,完全反应后的固体残渣是氯化钾和二氧化锰,氯化钾溶于水,二氧化锰不溶于水,因此可以通过溶解、过滤、洗涤、干燥的方法,回收得到较纯净的二氧化锰;故答案为:bcda
(4)A管上口高出B管上口的理由是:当漏斗内液体过少时,B管中进入空气,液体从A管流出,当液体浸没B管时,就停止加液体,便于达到“自动过滤”的目的;若A管上口低于B管上口或与B管上口平齐都不能实现“自动过滤”的目的;故答案为:便于达到“自动过滤”的目的;若A管上口低于B管上口或与B管上口平齐都不能实现“自动过滤”的目的(合理答案即得分)
点评:本考点既考查了实验步骤的设计,又考查了化学方程式的书写,还对实验进行了评价,综合性比较强.实验探究题是近几年中考的热点之一,它包括实验方法和过程的探究,实验结论和实验规律的探究等.本题通过实验资料和实验分析,得到了正确的结论,属于结论性探究.同学们要具体分析,综合掌握.
解答:解:(1)控制变量法只能控制一个变量,因此X是3.0;氧化铜与盐酸反应生成氯化铜和水;故答案为:①3.0 ②CuO+2HCl=CuCl2+H2O
(2)本实验中,测量O2体积的装置是C,因为氧气密度比水的密度小,必须从短管进入,才能把水排出来;由表格信息可知:在相同条件下,双氧水浓度越大,双氧水分解得快;用如图2装置进行实验,通过比较相同时间天平读数差值大小也能达到实验目的;故答案为:①C;②双氧水浓度越大; ③相同时间天平读数差值大小.
(3)用氯酸钾和二氧化锰的混合物制取O2,完全反应后的固体残渣是氯化钾和二氧化锰,氯化钾溶于水,二氧化锰不溶于水,因此可以通过溶解、过滤、洗涤、干燥的方法,回收得到较纯净的二氧化锰;故答案为:bcda
(4)A管上口高出B管上口的理由是:当漏斗内液体过少时,B管中进入空气,液体从A管流出,当液体浸没B管时,就停止加液体,便于达到“自动过滤”的目的;若A管上口低于B管上口或与B管上口平齐都不能实现“自动过滤”的目的;故答案为:便于达到“自动过滤”的目的;若A管上口低于B管上口或与B管上口平齐都不能实现“自动过滤”的目的(合理答案即得分)
点评:本考点既考查了实验步骤的设计,又考查了化学方程式的书写,还对实验进行了评价,综合性比较强.实验探究题是近几年中考的热点之一,它包括实验方法和过程的探究,实验结论和实验规律的探究等.本题通过实验资料和实验分析,得到了正确的结论,属于结论性探究.同学们要具体分析,综合掌握.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目


 某兴趣小组同学对实验室制备氧气的条件,及氧气的性质进行如下探究.
某兴趣小组同学对实验室制备氧气的条件,及氧气的性质进行如下探究.

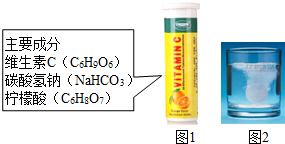 维C泡腾片(主要成分见图1)溶于水,有许多气泡产生(如图2).某兴趣小组同学对气体的成分进行如下探究.
维C泡腾片(主要成分见图1)溶于水,有许多气泡产生(如图2).某兴趣小组同学对气体的成分进行如下探究.