题目内容
【题目】根据下列图示,回答相关问题.
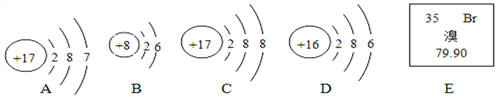
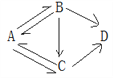
(1)A、B、C、D四种粒子中属于同种元素的是____(填字母,下同),与B的化学性质相似的是___.
(2)图E是溴元素在元素周期表的部分信息,溴的相对原子质量为_______.
(3)下图是某化学反应的微观示意图.
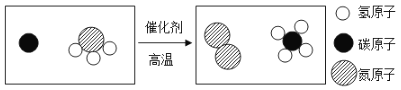
①上图中涉及的化合物有___种.
②该变化过程中不发生改变的粒子是____(填“分子”或“原子”).
③该化学反应中生成物的粒子个数比为_____.
【答案】 AC D 79.90 2(或两) 原子 2:3﹙或3:2﹚
【解析】在原子结构示意图中,小圆圈表示原子核,圆圈内的数字为质子数;弧线表示电子层,弧线上的数字为该层上的电子数。(1) 质子数决定原子的类别A、B、C、D四种粒子中属于同种元素的是AC,最外层电子数决定原子的化学性质。具有稳定结构的原子化学性质相似;非稳定结构的原子,最外层电子数一样的化学性质相似。原子核外只有一个电子层且电子数为2,或者最外层电子数为8的结构为稳定结构;与B的化学性质相似的是D;(2) 在元素周期表中,元素名称左上角的数字为原子的序数,右上角是该元素的符号。名称下边的数值是原子的相对原子质量。溴的相对原子质量为79.90;(3) ①由不同元素组成的纯净物叫化合物。上图中涉及的化合物有2种;②由图中信息可知,该变化过程中不发生改变的粒子是原子;③据质量守恒定律可知,反应前后原子的种类、个数不变,该化学反应中生成物的粒子个数比为2:3﹙或3:2﹚。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】氢氧化镍[Ni(OH)2]是某种混合动力汽车电池的一种材料。请参与下列探究:
【查阅资料】
Ⅰ.氢氧化是一种蓝绿色微溶于水的固体;硫酸镍溶液呈绿色;碳酸镍是一种浅绿色固体。
Ⅱ.能溶于水的酸、碱、盐溶于水时能电离成离子即以离子的形式存在,如:H2SO4=2H++SO42—;水溶液中的复分解反应一般朝着溶液中离子浓度(单位体积溶液中离子数目的多少)减小的方向进行。
【实验探究】
实验步骤 | 实验现象 | 实验结论 |
(1)取少量Ni(OH)2(新制)悬浊液于试管中,滴加过量稀硫酸,振荡 | 悬浊液变澄清,溶液呈绿色 | __________________ |
(2)取少量氢氧化镍(新制)悬浊液于试管中,滴加过量NaCO3溶液 | ______________ | Ni(OH)2能和NaCO3溶液反应 |
(3)向步骤(1)所得的澄清液中,滴加少量NaOH溶液 | 无明显现象 | 硫酸镍溶液不能和NaOH溶液反应 |
【分析讨论】
(1)Ni(OH)2中Ni的化合价为_____________。
(2)氢氧化镍和稀硫酸反应的化学方程式_______________________________。
(3)由上述实验可知,氢氧化镍在水中的溶解能力_____________(填:“大于”、“等于”或“小于”)碳酸镍。
(4)小顾认为步骤(3)得出的结论不合理,其理由是____________________。
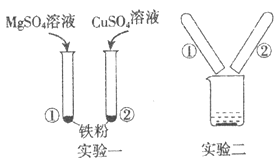
【题目】某化学兴趣小组的同学,为了比较金属R与铁、铜的金属活动性强弱,进行如下探究活动:
[查阅资料]铁的活动性比铜强.
[进行猜想]对三种金属的活动性顺序做出如下猜想:
猜想一:R>Fe>Cu; 猜想二:_______________; 猜想三:Fe>Cu>R
[收集证据]为了验证哪一种猜想成立,甲、乙、丙三位同学分别展开实验探究.
主要操作 | 主要现象 | 实验结论 | |
甲 | 将打磨好的R丝插入盛有硫酸铜溶液的试管中 | ______________ | 猜想一 正确 |
乙 | 将粗细相同打磨好的R丝、铁丝,分别插入体积和溶质质量分数都相同的稀盐酸中 | R丝表面产生气泡速率比铁丝表面产生气泡速率___(填“快”或“慢”) | |
丙 | 将粗细相同打磨好的R丝、铁丝,分别在空气中点燃 | R丝在空气中剧烈燃烧,铁丝在 空气中______ |
写出铁丝在氧气中燃烧的化学方程式__________________________________
[交流反思]三位同学交流讨论后认为,比较金属活动性强弱的方法有多种.
[归纳总结]他们总结得出比较金属活动性强弱的常见方法有:
(1)金属与氧气反应的难易和剧烈程度;
(2)金属与酸溶液是否反应或反应的剧烈程度;
(3)金属与_____是否反应.
【题目】向100gBaC12溶液中滴加CuSO4溶液至完全反应,反应过程中生成沉淀的质量与滴加CuSO4溶液的质量关系如下表所示(硫酸钡不溶于水),请计算:
滴加CuSO4溶液的质量/g | 10 | 20 | 30 | 40 |
生成硫酸钡的质量/g | 2.33 | 4.66 | 6.99 | 6.99 |
(1) 恰好完全反应时生成硫酸钡的质量为________g;
(2) BaC12溶液中溶质的质量分数为________(写出计算过程)。