题目内容
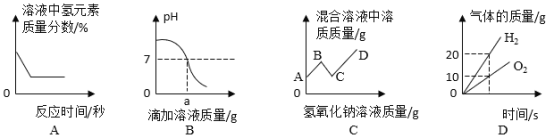
【题目】下列图像能正确反映对应变化关系的是( )
A.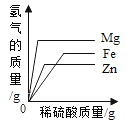 分别向相同质量的镁粉、铁粉、锌粉中加入等浓度稀硫酸
分别向相同质量的镁粉、铁粉、锌粉中加入等浓度稀硫酸
B.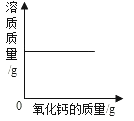 一定温度下,向饱和的氢氧化钙溶液中加入氧化钙固体
一定温度下,向饱和的氢氧化钙溶液中加入氧化钙固体
C.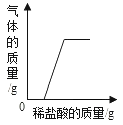 向一定量铁锈中加入稀盐酸
向一定量铁锈中加入稀盐酸
D.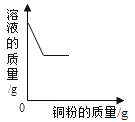 向一定量硝酸银溶液中加入铜粉
向一定量硝酸银溶液中加入铜粉
【答案】D
【解析】
A、向等质量的镁粉、铁粉、锌粉中分别加入浓度相同的稀硫酸时,随着稀硫酸的加入,硫酸和镁、铁、锌反应,一开始硫酸量不足,当反应的硫酸质量相等时,产生的氢气质量也相等,因此起始阶段重合,因为向等质量的镁粉、铁粉、锌粉中分别加入足量且浓度相同的稀硫酸,镁与稀硫酸反应:![]() ,铁与稀硫酸反应:
,铁与稀硫酸反应: ![]() ,锌与稀硫酸反应:
,锌与稀硫酸反应:![]() ,最终镁和稀硫酸反应生成的氢气多,故A错误;
,最终镁和稀硫酸反应生成的氢气多,故A错误;
B、氧化钙和水反应,生成氢氧化钙,所以水质量减少,溶剂质量减少,且该反应放热,氢氧化钙的溶解度随温度的升高而减小,溶液中有晶体析出,故溶质的质量减少,故B错误;
C、向一定量铁锈中加入稀盐酸,铁锈中只含有氧化铁,不含铁,故稀盐酸与铁锈反应不会放出气体,故C错误;
D、根据金属活动性顺序,铜能够将硝酸银中的银置换出来,![]() ,64份的铜置换出216份的银,固体质量增加,导致溶液质量变小,当反应完全后,溶液的质量保持不变,故D正确。
,64份的铜置换出216份的银,固体质量增加,导致溶液质量变小,当反应完全后,溶液的质量保持不变,故D正确。
故选D。

练习册系列答案
相关题目