题目内容
【题目】根据以下实验装置图回答下列问题:
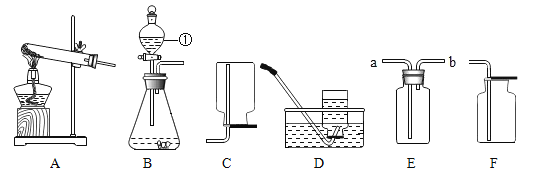
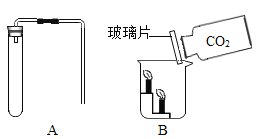
(1)写出图B中标号①的仪器名称_____。
(2)实验室用A装置制取氧气的化学方程式为_____。若想收集一瓶较纯净的氧气,选用的收集装置是_____(填字母序号)。
(3)实验室制取二氧化碳的化学方程式为_____。用E装置收集二氧化碳,证明是否集满时,应将燃着的木条放在_____(填“a”或“b”)端。
【答案】分液漏斗 2KClO3![]() 2KCl+3O2↑ D CaCO3+2HCl=CaCl2+H2O+CO2↑ b
2KCl+3O2↑ D CaCO3+2HCl=CaCl2+H2O+CO2↑ b
【解析】
(1)根据实验室常用仪器的名称可知,①是分液漏斗;故填:分液漏斗
(2)在装置A中,有酒精灯,试管口没有棉花,适合用氯酸钾制取氧气,化学方程式为:2KClO3![]() 2KCl+3O2↑;因为氧气不易溶于水,要收集较纯的氧气,可用排水法收集,即可选装置D作为发生装置;故填:2KClO3
2KCl+3O2↑;因为氧气不易溶于水,要收集较纯的氧气,可用排水法收集,即可选装置D作为发生装置;故填:2KClO3![]() 2KCl+3O2↑;D
2KCl+3O2↑;D
(3)实验室常用大理石(或石灰石)和稀盐酸反应制取二氧化碳,化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;因为二氧化碳的密度比空气大,不燃烧也不支持燃烧,所以用E装置收集二氧化碳,证明是否集满时,应将燃着的木条放在b端。故填:CaCO3+2HCl=CaCl2+H2O+CO2↑;b

【题目】合金的种类很多,用途非常广泛,黄铜是铜和锌的合金,它可以用来制造机器和电器的零件等,化学兴趣小组的同学欲测定实验室中某铜样品中铜的质量分数(不考虑黄铜中的其他杂质),请你参与他们的探究过程。
称量10g粉末状黄铜样品放入烧杯中,量取45mL稀盐酸分三次加到其中,每次充分反应后,测定生成氢气的质量,实验数据如表:
第一次 | 第二次 | 第三次 | |
加入稀盐酸的体积(ml) | 15 | 15 | 15 |
生成氢气的质量(g) | 0.04 | m | 0.02 |
试求:
(1)m的数值 。
(2)此黄铜样品中铜的质量分数是多少?(写出计算过程)