题目内容
【题目】有一包白色固体可能含碳酸钠、硫酸钠、氯化钾、硝酸钡、氢氧化钠中的一种或几种。某化学兴趣小组为探究其成分做了以下实验:
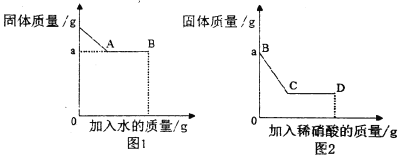
Ⅰ.取少量固体于烧杯中,逐渐加水并不断搅拌,烧杯内固体的质量随加入水的质量的变化如图1所示;
Ⅱ.取少量B点时的清液于试管中,滴加酚酞溶液,酚酞溶液不变色;
Ⅲ.继续向烧杯中滴加稀硝酸并不断搅拌,烧杯内固体的质量随加入稀硝酸的质量的变化如图2所示。
请回答下列问题:
(1)写出一个步骤I中发生反应的化学方程式:________________________
(2)BC段可观察到的现象是________________________________________,从C到D液体的pH________(填“增大”、“减小”或“不变”)
(3)原白色固体中一定含有________________________,可能含有________________;
(4)D点时,溶液中一定含有的溶质是________________________________;
【答案】(1)Ba(NO3)2+ Na2CO3===2NaNO3 +BaCO3↓(2) 固体部分溶解,有气泡产生;减少(3)碳酸钠、硫酸钠、硝酸钡;氯化钾 (4) 硝酸钠、硝酸钡、硝酸。
【解析】
试题分析:从图看出:物质加入水后能够得到沉淀,所以固体不能完全溶解,加入酸后,沉淀部分溶解,说明一部分沉淀能够和酸发生反应,过程中能够得到的沉淀是能够溶于酸的碳酸钡,和不能和酸反应的硫酸钡,所以物质中一定含有碳酸钠和硫酸钠和硝酸钡,步骤I中发生反应的化学方程式:Ba(NO3)2+Na2CO3===2NaNO3+BaCO3↓;BC段发生的反应是碳酸钡和酸的反应,可观察到的现象是固体部分溶解,有气泡产生,从C到D液体的pH减小,因为酸的量变大,原白色固体中一定含有碳酸钠、硫酸钠、硝酸钡;,可能含有氯化钾;D点时,溶液中一定含有的溶质是硝酸钠、硝酸钡、硝酸。

【题目】某兴趣小组的同学围绕着LNG船舶使用的金属材料进行了研究。
【阅读与思考】(1)在焊接不锈钢管道时,通常要使用氩气作保护气,这是因为氩气的化学性质 。
(2)金属在海水中易生锈腐蚀。造船工业为了避免轮船的钢铁外壳被腐蚀,通常在轮船外壳镶嵌另外一种金属。利用该金属与铁的活动性的不同,保护铁不易被腐蚀。

【研究课题1】一般情况下,两种活动性不同的金属在潮湿的环境中接触时,哪种金属先被腐蚀呢?
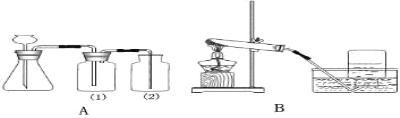
【实验设计1】将打磨后的金属片进行如图1所示的实验,放置一段时间后将观察到的现象及分析填入下表:
现象 | 分析 |
甲中:铝片表面出现灰白色物质,铁片表面几乎没有明显现象。 | 铝与铁在潮湿的环境中接触, 首先被腐蚀。 |
乙中:铁片表面出现 ,铜片表面几乎没有明显现象。 | 铁与铜在潮湿的环境中接触,铁首先被腐蚀。 |
【得出结论】一般情况下,两种活动性不同的金属在潮湿的环境中接触时,活动性较 填“强”或“弱”)的金属首先被腐蚀。
【知识应用】造船工业为避免轮船的钢铁外壳被腐蚀,通常在轮船外壳镶嵌的金属是 (填编号)。
A.银块 B.铜块 C.锡块 D.锌块
(3)LNG船还使用了大量的锌铜合金。
【研究课题2】测定锌铜合金中铜的质量分数
【实验设计2】进行如图2所示的实验。
(1)图中量气管和水准管可用来测量气体体积,为准确测量氢气的体积,在读取量气管中液面读数的过程中,应注意 (填编号)。
A.读数时视线与凹液面最低处相平
B.读数前应上下移动水准管,待两管液面相平再读数
C.保持水准管静止,待水准管中液面不再上升时再读数
(2)实验前,将已经打磨过的块状锌铜合金加工成碎屑,其目的是: 。
(3)实验操作步骤:检查气密性,将药品和水装入各仪器中,连接好装置后,再次检查装置的气密性,记录量气管的液面位置为5mL,由A向B滴加足量试剂,待B中不再有气体产生并恢复至室温后,记录量气管的液面位置为85mL;将B中剩余固体过滤,洗涤,干燥,用电子天平称其质量为0.416g。
【数据处理】该实验条件下,氢气的密度是0.09gL﹣1.根据上述的数据计算锌铜合金中铜的质量分数。
(请在答题卡上写出计算过程)