题目内容
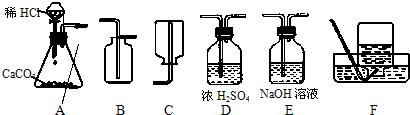
13、某实验探究小组的同学为了探究二氧化碳的性质,需要制取并收集干燥的CO2气体.以下是老师提供的一些实验装置.

(1)制取并收集干燥的CO2气体,可采用的装置组合是
(2)实验室制取CO2的化学方程式为
(3)实验室制取CO2,

(1)制取并收集干燥的CO2气体,可采用的装置组合是
ADB
(填字母).(2)实验室制取CO2的化学方程式为
CaCO3+2HCl=CaCl2+H2O+CO2↑.
.(3)实验室制取CO2,
不能
(填“能”或“不能”)将稀盐酸换成浓盐酸,理由是:浓盐酸具有挥发性,使生成的二氧化碳气体中含有氯化氢气体.
.分析:(1)稀盐酸与碳酸钙反应制取二氧化碳,浓硫酸可以吸收二氧化碳中的水蒸气,并不与二氧化碳反应,然后用排空气法收集即可;
(2)根据反应物稀盐酸和碳酸钙,生成物是氯化钙、水、二氧化碳写出反应式;
(3)浓盐酸具有挥发性,使制取的气体不纯.
(2)根据反应物稀盐酸和碳酸钙,生成物是氯化钙、水、二氧化碳写出反应式;
(3)浓盐酸具有挥发性,使制取的气体不纯.
解答:解:(1)制取二氧化碳可以用A装置中的稀盐酸与碳酸钙反应;制取的气体通过盛有浓硫酸的D装置,可以得到干燥的二氧化碳气体;因为二氧化碳的密度大于空气的密度,所以可用B装置收集.故可选:ADB;
(2)根据反应物稀盐酸和碳酸钙,生成物是氯化钙、水、二氧化碳,所以化学反应式是:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(3)浓盐酸具有挥发性,使制取的二氧化碳气体不纯,故不能换成浓盐酸;不能,理由是:浓盐酸具有挥发性,使生成的二氧化碳气体中含有氯化氢气体.
(2)根据反应物稀盐酸和碳酸钙,生成物是氯化钙、水、二氧化碳,所以化学反应式是:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(3)浓盐酸具有挥发性,使制取的二氧化碳气体不纯,故不能换成浓盐酸;不能,理由是:浓盐酸具有挥发性,使生成的二氧化碳气体中含有氯化氢气体.
点评:本题考查实验室制取二氧化碳的装置的选取、方程式的书写、以及药品的选取原则,同学们一定要熟悉常见气体的性质.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目