题目内容
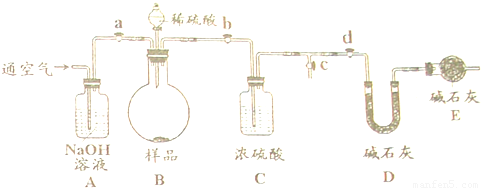
固体烧碱中往往含有少量碳酸钠.某实验探究小组的同学为了测定某烧碱样品中NaOH的质量分数,设计了如图所示的装置及操作步骤:
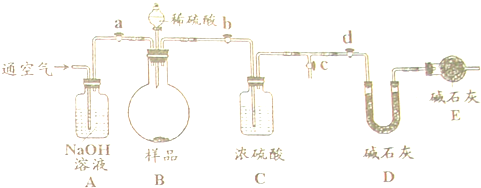
①检查装置的气密性;②准备称量10.00g样品装入烧瓶,并准备称量整个U行管质量;③打开活塞a、b、c,关闭活塞d,鼓入一段时间;④关闭活塞a、c,打开活塞b、d,将稀硫酸加入到烧瓶中,使样品全部反应完全;⑤关闭活塞c,打开活塞a、b、d,充分鼓入空气一段时间;⑥再次准备称量整个U形管质量,测得质量增加了0.44g.
回答下列问题:
(1)步骤③中鼓入空气一段时间的目的是
(2)装置A的作用是
(3)步骤⑤中还要再鼓入空气的目的是
(4)计算烧碱样品中NaOH的质量分数.(可能用到的相对原子质量:H-1 C-12 O-16Na-23 S-32)

①检查装置的气密性;②准备称量10.00g样品装入烧瓶,并准备称量整个U行管质量;③打开活塞a、b、c,关闭活塞d,鼓入一段时间;④关闭活塞a、c,打开活塞b、d,将稀硫酸加入到烧瓶中,使样品全部反应完全;⑤关闭活塞c,打开活塞a、b、d,充分鼓入空气一段时间;⑥再次准备称量整个U形管质量,测得质量增加了0.44g.
回答下列问题:
(1)步骤③中鼓入空气一段时间的目的是
排除装置中的二氧化碳
排除装置中的二氧化碳
;(2)装置A的作用是
吸收空气中的二氧化碳
吸收空气中的二氧化碳
;装置C的作用是吸收气体中的水蒸气
吸收气体中的水蒸气
;(3)步骤⑤中还要再鼓入空气的目的是
使生成的二氧化碳全部被吸收
使生成的二氧化碳全部被吸收
.(4)计算烧碱样品中NaOH的质量分数.(可能用到的相对原子质量:H-1 C-12 O-16Na-23 S-32)
分析:可以根据物质的性质以及相互作用时的实验现象判断物质的组成,并根据化学方程式进行相关方面的计算.从实验给定的流程中分析命题人的设计思路,氢氧化钠溶液能吸收空气中的二氧化碳,碳酸钠与硫酸反应生成的二氧化碳可以被碱石灰吸收,根据生成的二氧化碳的质量可计算碳酸钠的质量,进而计算烧碱样品中氢氧化钠的质量分数.
解答:解:(1)步骤③中鼓入空气一段时间的目的是排除装置中的二氧化碳,这样可以准确测定生成的二氧化碳的质量;故答案为:排除装置中的二氧化碳;
(2)装置A中的氢氧化钠溶液能和二氧化碳发生反应,故其作用是吸收空气中的二氧化碳;装置C中的浓硫酸有吸水性,故其作用是吸收气体中的水蒸气;故答案为:
吸收空气中的二氧化碳;吸收气体中的水蒸气;
(3)步骤⑤中还要再鼓入空气的目的是使生成的二氧化碳全部碱石灰被吸收,使称量结果更准确.故答案为:使生成的二氧化碳全部被吸收;
(4)设碳酸钠的质量为X
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
X 0.44g
=
X=1.06克
碳酸钠的质量分数为:
×100%=10.6%.
答:碳酸钠的质量分数是10.6%.
(2)装置A中的氢氧化钠溶液能和二氧化碳发生反应,故其作用是吸收空气中的二氧化碳;装置C中的浓硫酸有吸水性,故其作用是吸收气体中的水蒸气;故答案为:
吸收空气中的二氧化碳;吸收气体中的水蒸气;
(3)步骤⑤中还要再鼓入空气的目的是使生成的二氧化碳全部碱石灰被吸收,使称量结果更准确.故答案为:使生成的二氧化碳全部被吸收;
(4)设碳酸钠的质量为X
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
X 0.44g
| 106 |
| 44 |
| x |
| 0.44g |
X=1.06克
碳酸钠的质量分数为:
| 1.06g |
| 10g |
答:碳酸钠的质量分数是10.6%.
点评:本题主要考查了化学方程式的书写、根据化学方程式计算、判断物质的组成等方面的问题,要从物质的性质入手分析.

练习册系列答案
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目