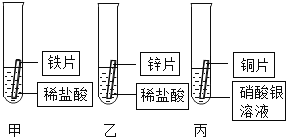
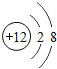题目内容
【题目】了解微观原理有助于我们认识宏观世界。
(1)图中A.B.C.D.E是五种粒子的结构示意图.请回答下列问题:
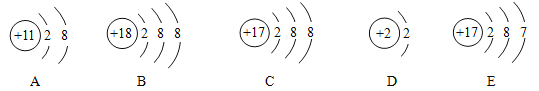
①图中A.B.C.D.E共有_____种元素;属于阴离子的是____.(填选项字母)
②A.B.C.D.E五种粒子中,与B化学性质相似的原子是____(填选项字母)
③从粒子E的结构示意图可以判断该元素位于元素周期表的第______周期.
④NaCl是由以上哪些粒子构成的_____
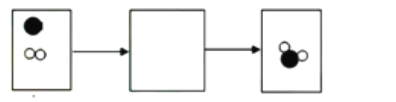
(2)如下图是某反应的微观过程示意圈,其中“![]() ”和“
”和“![]() ”表示两种不同的原子.请根据图示回答
”表示两种不同的原子.请根据图示回答
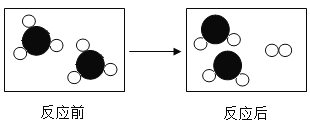
①反应的基本类型是_____反应
②反应后的物质____(填 “是”或 “不是”)混合物
③在该反应前后肯定没有变化的是____.(填选项字母)
A 原子数目
B 分子数目
C .元素种类
D 物质种类
E 原子种类
F分子种类
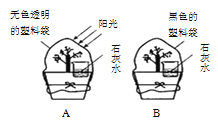
(3)燃烧灭火的原理在化学实验中有许多应用,结合如图所示实验.回答下列问题:
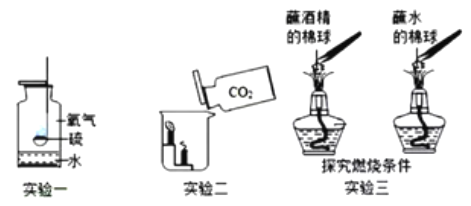
①在实验一中,硫燃烧产生____火焰。此时若想将硫熄灭,可以将燃烧匙伸入水中,这是利用灭火原理中的_____ 以下是该反应的微观模拟图,请把中间部分补充完整:_________:
②由实验二可知, CO2具有的物理性质是____
③在实验三中,棉球上的酒精燃烧而水不燃烧,由此得出燃烧条件之一是_____
④一段时间后,蘸水的棉球也燃烧了,是因为_____
A 温度达到了水的着火点
B 温度达到了棉球的着火点
C 棉球是可燃物且与空气接触
【答案】4 C D 三 AC 分解 是 ACE 蓝紫色 降低可燃物温度到火点以下(或隔绝氧气) ![]() 密度大于空气 需要可燃物 BC
密度大于空气 需要可燃物 BC
【解析】
(1)①根据粒子的结构示意图及元素的种类由质子数决定,A、B、C、D、E五种粒子共表示4元素,其中C粒子的质子数是17,电子数是18,是氯离子,属于阴离子;
②最外层电子数决定元素的化学性质,与B化学性质相似的原子是D;
③根据E图中获得的信息有:原子核外有3个电子层,根据电子层数决定周期可知:该元素位于元素周期表的第3周期;
④NaCl是由钠离子和氯离子构成的;
(2)①由图示可知,反应前含有一种分子即为一种物质,反应后存在两种分子即为两种物质,符合分解反应“一变多”的特性;
②由物质的构成可知,反应后的物质是由两种分子构成的,属于混合物;
③由微粒的变化可知,该反应前后原子的种类、数目不变化,元素的种类和物质的总质量不变,分子的种类、分子的数目发生了变化;
(3)①硫在氧气中燃烧产生蓝紫色火焰;将燃烧匙伸入水中,利用的降低可燃物温度到火点以下(或隔绝氧气);根据化学反应中分子离解成原子,原子的种类及数目不变可知,中间部分为:![]() ;
;
②下层的蜡烛先熄灭,上层的蜡烛后熄灭,说明了CO2密度比空气的大;
③小棉花球蘸水后,因水不可燃,反而会蒸发吸收热量,所以温度达不到棉花的着火点,不会燃烧;而小棉花球蘸酒精后,酒精是可燃物,在酒精灯上被点燃后会燃烧放出大量的热,使温度达到棉花的着火点,引发棉花球燃烧,因此实验的结论是燃烧的物质必须是可燃物;
④酒精燃烧产生热量,一段时间后,水分蒸发了,棉球是可燃物且与空气接触且温度达到了棉球的着火点,所以棉球能燃烧。故选BC。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】为研究化学反应前后反应物与生成物之间的质量关系,做了下列三个实验。
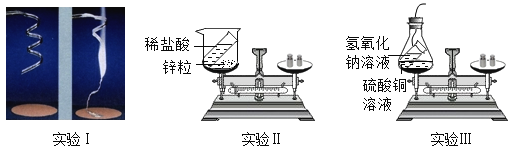
实验Ⅰ:称量镁条,点燃,待反应结束后,再称量。实验Ⅱ:将盛有稀盐酸的小试管放入装有锌粒的烧杯中,称量,然后将稀盐酸与锌粒接触,过一会儿再称量。实验Ⅲ:将装有氢氧化钠溶液的试管放入盛有硫酸铜溶液的烧杯中,称量,然后设法将两种溶液接触(有蓝色氢氧化铜沉淀和硫酸钠生成),过一会儿再称量。数据见下表:
编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
反应前 | 4.8g | 112.6g | 118.4g |
反应后 | 6.0g | 112.4g | 118.4g |
(1)从表面上看,这三个实验中,发生化学反应前后物质的质量:实验Ⅰ_____;实验Ⅱ_____;实验Ⅲ_____。(填“增大”、“减小”或“不变”)
(2)造成此结果的原因可能是_____。
(3)这三个实验中,实验_____正确地反映了反应物与生成物之间的质量关系。
(4)从不能正确反映反应物与生成物之间质量关系的实验中,选一例说明实验设计的不恰当之处,并提出改进思路:_____。
(5)由此可得出,在做实验研究化学反应前后反应物与生成物之间的质量关系时,必须在_____体系中进行。