题目内容
【题目】碳作为能源首选目标的时代正在逐渐成为历史,科学家正在研究一种新能源﹣﹣硅。
(1)硅的相对原子质量是28.09,如图为硅原子结构示意图。
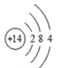
请把图所示硅在元素周期表中的信息补充完整。
_____ Si
硅
_______
_____ Si
硅
_______
(2)硅在氧气中燃烧释放能量,生成+4价硅的化合物,该化合物的化学式为_____。
(3)工业上用四氯化硅制取硅,其反应的化学方程式是:SiCl4+2H2![]() Si+4x。则x的化学式是___,其反应的基本类型是___。
Si+4x。则x的化学式是___,其反应的基本类型是___。
【答案】14 28.09 SiO2 HCl 置换反应
【解析】
(1)根据元素周期表提供的信息,原子序数=核外电子数=质子数=2+8+4=14,所以该元素的质子数为14;根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,元素的相对原子质量为28.09,左上角的数字是14,最下面的数字是28.09,故填:
 ;
;
(2)硅在氧气中燃烧释放能量,生成+4价硅的化合物,该化合物的化学式为SiO2;
(3)根据化学方程式SiCl4+2H2![]() Si+4x可知,反应前:1个硅原子,4个氯原子和4个氢原子;反应后:1个硅原子,根据质量守恒定律的元素守恒、原子种类和个数不变,因此4X中含有4个氢原子和4个氯原子,故1个X的化学式为HCl;该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应。
Si+4x可知,反应前:1个硅原子,4个氯原子和4个氢原子;反应后:1个硅原子,根据质量守恒定律的元素守恒、原子种类和个数不变,因此4X中含有4个氢原子和4个氯原子,故1个X的化学式为HCl;该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应。

【题目】小科冋学阅读课外资料得知,某些氧化物可代替二氧化锰作一些反应的催化剂,于是她对此产生了探究兴趣、
(提倡问题)氧化铜能否作氯酸钾分解的催化剂?
(设计实验)小科设计了下列三组实验(其他可能影响实验的因素均忽略)
实验编号 | KC1O3/g | 氧化物 | 产生气体的体积(mL) | 耗时(s) |
1 | 0.6 | / | 9.8 | 480 |
2 | 0.6 | 0.2g氧化铜 | 67 | 90 |
3 | 0.6 | 0.2g二氧化锰 | 67 | 37 |
(1)写出氯酸钾用二氧化锰作催化剂的化学方程式______。
(2)从实验1与实验2的数据可知,氧化铜______(选填“能”或“不能”)加快氯酸钾的分解速率。
(3)为证明氧化铜是该反应的催化剂,小科又完成了以下的实验。
1,将实验2反应后的混合物加足量的水溶解,过滤,洗涤并十燥,用天平称量,质量为0.2g。
Ⅱ.将过量的CO通入滤出的固体,按如图进行实验,小科同学的实验报告如下表,请填写空格中的内容。
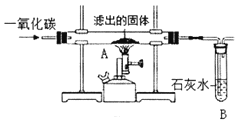
装置 | 现象 | 结论 |
A | ______ | 生成了铜 |
B | 澄清的石灰水变成浑浊 | 产生了二氧化碳 |
(得出结论)通过I、Ⅱ实验证明氧化铜能作氯酸钾分解的催化剂。
(反思与评价)
从环保角度分析,上图装置有不足之处,你认为该如何改进?______。
【题目】兴趣小组同学为了测定某中碳酸钙的质量分数,称取25.0g珍珠粉样品,进行四次高温煅烧、冷却、称量剩余固体的重复操作(杂质不参加反应),记录数据如下:
操作次数 | 第1次 | 第2次 | 第3次 | 第4次 |
剩余固体质量(g) | 21.6 | 19.2 | 16.2 | 16.2 |
试计算:
(1)完全反应后生成二氧化碳的质量是__g。
(2)求珍珠粉中碳酸钙的质量分数。(写出计算过程)__________.