��Ŀ����
����Ŀ����������ӭ��������ͨ��չ�ĸ߳������������Ǵ����IJ����ǽ�ͨ���㣬���п�ݣ������Ǵ�������ҵ�ķ��١�����������Ҫ�����ĺϽ�֣��¼���ѧ��ѧ��ȤС��Ϊ��չ��̽����
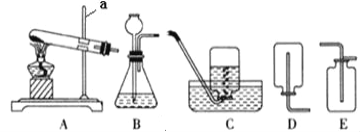
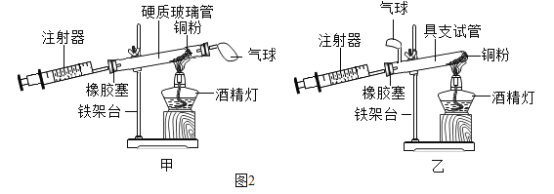
��һ����ҵ���������ֺ����Ƹֲĵ���Ҫ��������ͼ��
��֪�������ĺ�̼��Ϊ2%~4.3%,�ֵĺ�̼��Ϊ0.03%~2%��
��1�������Ĺ���ԭ���м��뽹̿��������_____��_____���÷���ʽ��ʾ����
��2�������Ĺ���ԭ���辭�����飬��Ŀ����_____��
��3���ȿ�����¯�������Ҫ�ɷ���һ����ͬ������������_____���ѧʽ����
��4������¯�У�ͨ�봿�������ÿ�����Ŀ����_____�����ֶ����ɸְ壬�����˽�����_____�ԡ�
����������ȤС�鷢��δ�������ĸ����������⡣ͬѧ�ǽ���̽�����������������⡣
��֪ʶ�عˣ������������Ϊ����_____��_____ͬʱ�Ӵ���Ϊ�˷�ֹ����Ʒ���⣬Ӧ��ȡ�Ĵ�ʩ��_____��д��һ�֣���
���������ϣ�����ɷָ��ӣ���ѧʽ�ɼ�ʾΪFe2O3nH2O���ڼ���ʱ��ֲ���Ӧ������ʧȥ�ᾧˮ���䷴Ӧ�ɱ�ʾΪFe2O3nH2O![]() Fe2O3+nH2O��Ũ���������ˮ����ʯ�ҿ�������ˮ�Ͷ�����̼��
Fe2O3+nH2O��Ũ���������ˮ����ʯ�ҿ�������ˮ�Ͷ�����̼��
��������⣩���⣨Fe2O3nH2O����n��ֵ���ڶ����أ�
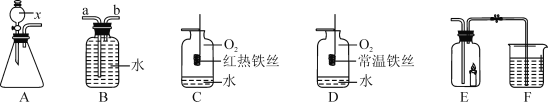
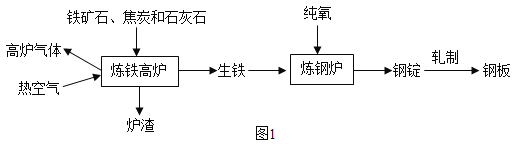
������̽����С������ʵ��������һ���ܲ��Ƶ����ۣ����Ѿ����ɺ��ɫ��Ϊ��̽�����⣨Fe2O3nH2O������ɣ���ȡ27.0g����������Ʒ������ͼ2��ʾװ�ý���ʵ�顣
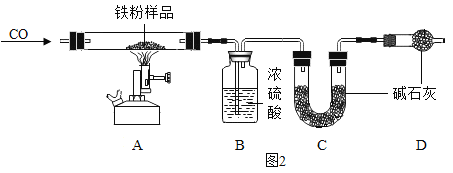
��1��ʵ��ǰӦ��_____��
��2��Ϊ�˱�֤ʵ�鰲ȫ��ʵ�鿪ʼʱӦ��_____��Ŀ����_____��
��3��D��������_____��
��4����ָ����װ������һ�����Բ���_____��
�����ݴ�����ͼ3�Ǽ���ʱ���A�й���������ϵͼ���±���B��C���������ٱ仯ʱB��Ũ���ᡢC�м�ʯ��װ�������仯�����
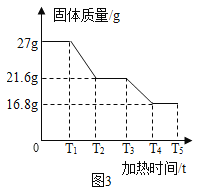
��Ӧǰ��g�� | ��Ӧ��g�� | |
B | 100 | 105.4 |
C | 150 | 163.2 |
��5�����⣨Fe2O3nH2O����n��ֵ��_____��
��6��д��T3��T4ʱ��η�����Ӧ�Ļ�ѧ����ʽ_____��
��7������ԭ��Ʒ�е�����������������_____����������������0.1%��
���𰸡�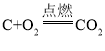
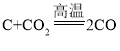 ����Ӧ��Ӵ�������ӿ췴Ӧ����
����Ӧ��Ӵ�������ӿ췴Ӧ���� ![]() ����ʹ�����е�̼��ַ�Ӧ�����ͺ�̼�� ��չ ���� ˮ ˢ�� ���װ�������� ͨ��һ���һ����̼ �ž�װ���ڵĿ������Է�����ʱ������ը ��ֹ�����еĶ�����̼��ˮ����Cװ�� û��β������װ�� 3
����ʹ�����е�̼��ַ�Ӧ�����ͺ�̼�� ��չ ���� ˮ ˢ�� ���װ�������� ͨ��һ���һ����̼ �ž�װ���ڵĿ������Է�����ʱ������ը ��ֹ�����еĶ�����̼��ˮ����Cװ�� û��β������װ�� 3 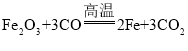 20.7%
20.7%
��������
̼�������е�ȼ���ɶ�����̼��̼�������������������Ͷ�����̼�������������Ϊ����������ˮͬʱ�Ӵ��Ľ����
��1�������Ĺ���ԭ���м��뽹̿���������ṩ��ԭ����ʯ����������ȡ��ԭ��һ����̼
��Ӧ�Ļ�ѧ����ʽΪ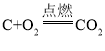 ��
��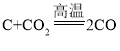 ��
��
��2�������Ĺ���ԭ���辭�����飬��Ŀ��������Ӧ��Ӵ�������ӿ췴Ӧ���ʡ�
��3�������Ļ�ѧ�����ȶ�,�ȿ����еĵ���û�в��뷴Ӧ,�����ŷų��ĸ�¯������Ҳ���е�������ѧʽΪ![]() ��
��
��4������¯��ͨ�봿�������ÿ�����Ŀ���ǿ���ʹ�����е�̼��ַ�Ӧ�����ͺ�̼�������ֶ����ɸְ壬�����˽�������չ�ԡ�
������[֪ʶ�ع�]�����������Ϊ����������ˮͬʱ�Ӵ���Ϊ�˷�ֹ����Ʒ���⣬Ӧ��ȡ�Ĵ�ʩ��ˢ�ᡣ
[����̽��]
��1��ʵ��ǰӦ�ȼ��װ�������ԡ�
��2��һ����̼���п�ȼ�ԣ�������л�ϵ�ȼ����ȿ��ܻᷢ����ը��Ϊ�˱�֤ʵ�鰲ȫ��ʵ�鿪ʼʱӦ��ͨ��һ���һ����̼��Ŀ�����ž�װ���ڵĿ������Է�����ʱ������ը��
��3��D���Ǽ�ʯ�ң������Ƿ�ֹ�����еĶ�����̼��ˮ����Cװ�á�
��4��һ����̼�ж�����װ��û��β������װ�ã�ֱ���ŵ��ſ����л������Ⱦ���ʸ�װ������һ�����Բ�����û��β������װ�á�
[���ݴ���]
��5����������ʱ������ʧȥ�ᾧˮ���ᾧˮ������Ϊ![]() ����Ӧ����ˮ������Ϊ
����Ӧ����ˮ������Ϊ![]() ����Ӧ���ɶ�����̼����Ϊ
����Ӧ���ɶ�����̼����Ϊ![]()
��������������Ϊx

![]()
x=16g![]()
n=3
�����⣨Fe2O3nH2O����n��ֵ��3��
��2��T3-T4ʱ���ʱ�� ��������һ����̼���·�Ӧ�������Ͷ�����̼��������Ӧ�Ļ�ѧ����ʽΪ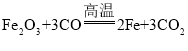
��3����Ʒ�����������Ϊ![]() ����ԭ��Ʒ�е���������������Ϊ
����ԭ��Ʒ�е���������������Ϊ
![]()

 ѧ���쳵�����ּ��ں�����ҵϵ�д�
ѧ���쳵�����ּ��ں�����ҵϵ�д� ��˼ά������ҵϵ�д�
��˼ά������ҵϵ�д�