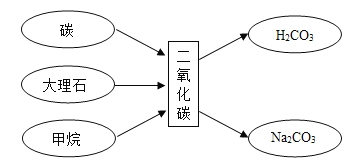
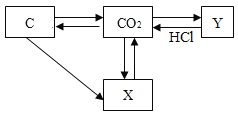
题目内容
【题目】金属是宝贵的自然资源。请回答下列问题:
(1)使用铝制作高压电线是利用了铝的_____性。
(2)钛合金常用于航空航天飞行器制造,钛合金属于_____(选填“纯净物”或“混合物”)。
(3)2019年猪年贺岁纪念币是使用铜合金材质铸造而成的,选择铜合金的原因是_____。
(4)红宝石因含有氧化铬而呈红色,已知:铬的元素符号为Cr,氧化铬中铬元素的化合价为+3价,则氧化铬的化学式为_____。
(5)工业上常用电解熔融氯化钠(NaCl)的方法冶炼金属钠。熔融状态下的氯化钠在通电的条件下分解生成金属钠和氯气(Cl2),此反应原理可用化学方程式表示为_____。
【答案】导电 混合物 铜合金的硬度大,耐腐蚀 Cr2O3 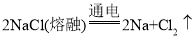
【解析】
(1)使用铝制作高压电线是利用了铝的导电性;
(2)钛合金是钛金属和其他金属混合制成的,属于混合物;
(3)纪念币选择铜合金的原因是铜合金的硬度大,耐腐蚀;
(4)氧化铬中铬元素的化合价为+3价,氧元素的元素符号是-2价,故氧化铬的化学式为Cr2O3;
(5)熔融状态下的氯化钠在通电的条件下分解生成金属钠和氯气,反应的化学方程式为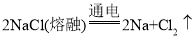 。
。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案【题目】小明对铁的锈蚀进行如下探究,室温时,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,装置如图,观察到量筒内水沿导管慢慢进入广口瓶(净容积为146mL)。当温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零)。记录起始和最终量筒的读数以及所需时间如表。
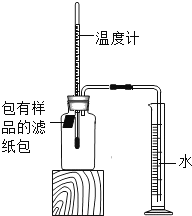
序号 | 样品 | 量筒起始 读数/mL | 量筒最终 读数/mL | 所需时间 /min |
1 | 1g铁粉、0.2g碳和10滴水 | 100 | 70 | 约120 |
2 | lg铁粉、0.2g碳、10滴水和少量NaCl | 100 | 70 | 约70 |
3 | …… | 100 | 70 | 约480 |
(1)实验①和②说明NaCl可以_____铁锈蚀的速率。
(2)实验开始后,广口瓶内温度有所上升,说明铁的锈蚀过程是_____(填“放热”或“吸热”)过程。
(3)实验结束后取出滤纸包,观察到有红棕色物质生成,该物质的化学式是_____。
(4)已知含碳能够加快铁的生锈速度,小明想通过实验①和③是探究碳对铁锈蚀速率的影响,请在表格空白处填写实验③的样品组成_____。
(5)该装置还可用于测量空气中氧气的含量,根据上述数据计算氧气的体积含量是_____(小数点后保留1位)。