题目内容
【题目】双氧水是一种无色液体,在二氧化锰的催化作用下能迅速分解出氧气和水。分液漏斗可以通过调节活塞控制液体的滴加速度。实验室常用这种方法制取氧气。回答下列制取氧气的问题:
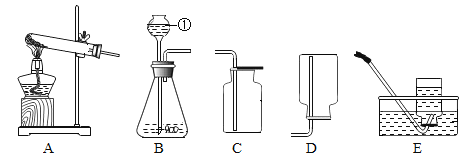
(1)分液漏斗应放入的物质是_______________。
(2)要收集一瓶纯净的氧气,应选择装置____________(填字母)
(3)若实验时用此法代替高锰酸钾加热制取氧气,则优点是____________(填编号)。
①生成物只有氧气②不需加热③需加热
(4)如果锥形瓶中的反应很剧烈,请提出实验安全注意事项_____________(填编号)。
①控制液体的滴加速度②用体积较小的锥形瓶③加热锥形瓶
(5)现用加热高锰酸钾的方法制取氧气并验证氧气的性质。
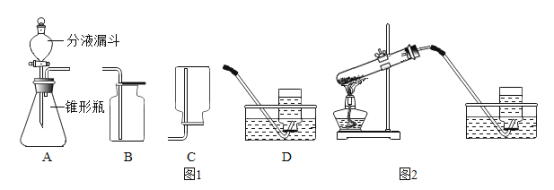
①装置图2中共有______________处错误。
②收集满氧气后,应用玻璃片盖住集气瓶口,并____(填“正放”或“倒放”)在桌上。
③他们用这种方法收集了两瓶气体。在先收集的一瓶插入带火星的木条,只看到火星亮了一些,插入后收集的一瓶木条则能复燃。导致这个现象的可能的原因是(写出操作上的原因):__________________。
【答案】过氧化氢溶液 D ② ① 2 正放 导管口刚有气泡冒出就开始收集
【解析】
(1)实验室使用A装置制取氧气,使用的是固液混合不加热法制取氧气。长颈漏斗中应该存放液体药品过氧化氢溶液,锥形瓶中应该放置固体药品二氧化锰。故答案为:过氧化氢溶液;
(2)使用排空气法收集到的气体干燥但不纯,使用排水法收集到的气体潮湿但纯净。若想要收集到一瓶纯净的氧气,应该使用排水法收集。故答案为:D;
(3)使用过氧化氢溶液制取氧气,相较于加热高锰酸钾制取氧气,实验操作简便,且不需要加热,节约能源。故答案为:②;
(4)如果锥形瓶中的反应很剧烈,可以通过开关来调整过氧化氢溶液的流速,从而控制化学反应的剧烈程度。故答案为:①;
(5)①如图的实验操作中,加热高锰酸钾制取氧气,试管口应该略向下倾斜,并且要在试管口放上一团棉花。共计2处错误。故答案为:2;
②利用排水法收集到氧气后,应该在水下盖上玻璃片后正放在桌面上,防止氧气密度大于空气,从而导致氧气的逸出。故答案为:正放;
③小组同学观察到在先收集的一瓶插入带火星的木条,只看到火星亮了一些,插入后收集的一瓶木条则能复燃。这说明,先收集到的氧气纯度较低,则导致此现象的原因可能是右侧导管有气泡就开始收集。因为此时的产生的气泡并不是氧气,而是受热膨胀的空气,从而导致氧气不纯。故答案为:导管口刚有气泡冒出就开始收集。

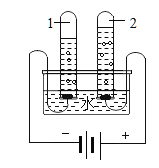
【题目】我国劳动人民早在五千年前就会使用木炭炼铜。在化学实验室里模拟炼铜,既可用传统的实验装置(图甲),又能用改进的微型实验装置(图乙)。某化学兴趣小组采用图乙装置,开展以下探究活动。
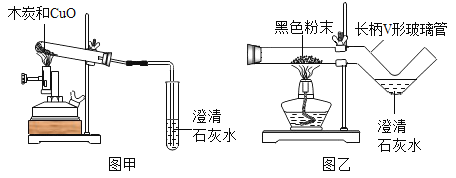
(提出问题)木炭与CuO反应所得的红色固体中含有什么物质?
(查阅资料)若木炭与CuO的反应进行得不彻底,产物中还有氧化亚铜(Cu2O)。
Cu2O是红色固体,能与稀硫酸反应(Cu2O+H2SO4=Cu+CuSO4+H2O)。铜不与稀硫酸发生反应。
(做出猜想)红色固体的成分:①全部是Cu;②全部是(Cu2O);③_____。
若猜想①成立,请写出木炭与氧化铜反应的化学方程式_____。
(实验探究)(1)取木炭、CuO两种黑色粉末适量均匀混合,然后将黑色粉末装入长柄V形玻璃管的直管内。
(2)按图乙连好实验装置,然后加热反应物2分钟后,黑色粉末出现红热现象,同时澄清的石灰水_____,此时停止加热。
(3)待玻璃管冷却后,提取里面的红色固体,进行如下表所示的实验验证:
步骤 | 现象 | 结论 |
a.取2.88g红色固体装入试管中,滴入足量的稀硫酸,充分反应。 | 红色固体部分减少,溶液变为蓝色。 | 猜想_____错误。 |
b.滤出试管中残留的红色固体,洗涤干燥,称其质量为2.08g | 猜想_____正确。 |
(反思与评价)使用图乙装置与使用图甲装置相比,其优点是_____(写一条即可)。
(拓展)由上述探究可知,反应生成了Cu2O。请写出木炭与CuO反应生成固体中只有Cu2O的化学反应方程式_____;根据上述探究(3)的实验结果可知,2.88g红色固体中Cu2O的质量为_____。